锂离子电池正极材料原理、性能与生产工艺
正极材料是锂离子电池的核心关键材料,我国是锂离子电池正极材料生产大国,有些材料品种如磷酸铁锂、钴酸锂、三元系材料的产量已居世界首位,但生产技术水平及产品质量与日韩等锂离子电池生产强国相比还有较大差距。
本文系统总结了锂离子电池正极材料合成的理论基础,如材料合成的热力学分析、反应动力学模型,材料结构与性能之间的关系,材料性能与电池制造之间的关系。
在生产实践方面,对原材料选择与标准建立、生产工艺流程优化、生产设备选型与设计、产品性能表征与标准建立、产品应用分析等方面进行了系统分析与总结,在正极材料产品研发与生产之间架起了一座桥梁,使研发人员能面向生产和市场,即研发成果能转换成产品和商品,从而实现科研成果向生产力的转换。
1.1 电池概述
电池是一种古老但又有着光明未来的人类发明。早在2000多年前,两河流域的文明中就已经出现了电池的原形。到了工业革命时期的1800年,伏打电堆的出现是电池发展史上第一个重要的里程碑。它标志着电池这种便携式能量包进入人类社会并助推人类文明向前发展。
电池是通过电化学反应将电极材料的化学能转化为电能的装置。根据电化学反应的可逆与否,电池可以分为一次电池和二次电池。一次电池使用一次后即废弃,如锌锰电池、碱性电池、银锌电池等等;而二次电池可以充放电使用多次,如镍镉电池、镍氢电池、锂离子电池等。
最早的二次电池是铅酸电池,是由法国物理学家普朗特(Plante)于1859年发明的。它以二氧化铅为正极,铅为负极,稀硫酸为电解液。单个电池的电动势为2V,常用作机动车辆的储能电池。
镍镉电池在1984年开始普及并取代小型电器中的一次电池。然而,由于镉对环境的有害影响,镍镉电池如今已不被广泛使用。在20世纪90年代早期出现了镍氢电池,相对于镍镉电池,镍氢电池对环境友好且性能更好。紧随其后出现的锂二次电池由于能量密度得到显著提高,结构紧凑且质量轻,因此迅速占领了便携式设备的市场,包括手机、笔记本电脑和摄像机等等。
锂二次电池在目前所有可实际应用的电池中具有最高的能量密度,是现阶段产量最大的二次电池。2016年全球的锂离子电池总出货量达到115.4GWh,市场规模达到了1850亿元。
1.2 锂离子电池的发展史
锂离子电池发展的第一阶段为锂电池,锂电池的发展可追溯到20世纪50年代末,锂引起了科学研究人员的极大兴趣。因为锂是最轻的金属元素,相对原子质量6.94,密度0.534g/cm3, 同时Li+/Li电对的电极电势很低,相对标准氢电极为3.04V,因此组成电池时能够带来很大的能量密度。
在锂电池出现之前的所有电池体系中,电解液均为水溶液,受到水的分解电压(1.23V)的限制,即使考虑过电位,这些电池的工作电压也都在2V以下。金属锂很活泼,与水会有剧烈的反应,因此无法使用传统的水溶液体系作为电解液。
1958年,加州伯克利大学的W.S.Haris在其博士毕业论文中指出,金属锂可稳定存在于环酯和内丁酯中,同时很多理盐在这类有机溶剂中有较高的溶释度和电导率。1962年在波士顿召开的ECS第122次秋季会议上,ChiltonJr.和Cook首次提出了“锂非水电解质体系”的概念。但在构造实际可用的理电池的过程中,寻找稳定的电解液和可逆的正极材料是主要的课题。
早期,大量卤化物如AgCl、CuCl2、 CuCl、 CuF2和NiF2作为电极材料被广泛研究,但它们的低电子电导、放电产物的可溶性和循环中体积变化大等问题无法很好解决。20世纪60~70年代的石油危机加速了人们对新能源的追求,大量科研力量投入了新型高能量电池的研究。
1968年, 日本松下公司和美国海军分别申请了由(CFx)n(0.5<x<1)和(C.F)n(3.5<x<7.5)作为正极材料组成的金属锂一-次 电池的专利。1973年松下实现Li/(CF)n锂一次电池的销售 。1975年, 日本三洋公司首先将Li/MnO2电池商品化。
为了实现锂电池的可充放电性,大量的研究集中于寻找同时具有高电导和高电化学反应活性的可嵌型化合物上。早在20世纪60年代末,贝尔实验室和斯坦福大学的两个独立的研究团队发现一些硫族化合物如TiS2能发生层间嵌脱反应。
1972年Steel和Armand正式提出了“电化学嵌入”这一概念, 奠定了开发锂二次电池商业化技术的基础。1976M.S.Whittingham在Science 上发表文章,介绍了TiS2-Li电池,其工作电压达到了2.2V。此后,处于充电态的层状硫化物获得了广泛的研究。美国Exxon公司开发了扣式L/TiS2蓄电池,加拿大的Moli公司推出了圆柱形Li/MoS2锂二次电池,并于1988年前后投入规模生产及应用。这两种电池的工作电压都在2V左右。由于尽管在金属锂表面形成的固态电解质界面膜(SEI)具有锂的穿透性,但锂的不均匀沉积会导致锂枝晶,它可以穿透隔膜,引起正负极短路,从而引发严重的安全问题,Moli公司的爆炸事件几乎使锂二次电池的发展陷于停顿。
为了克服因使用金属锂负极带来的安全问题,Murphy等人建议采用插层化合物以取代金属锂负极。这种设想直接导致了在20世界80年代末和90年代初出现的所谓“摇椅电池”:采用低插锂电势的嵌锂化合物代替金属锂为负极,与具有高插锂电势的嵌锂化合物组成锂二次电池,彻底解决锂枝晶的问题。这与后来发展的锂离子电池是同一概念。
另外,为了解决由于嵌锂化合物代替金属锂为负极引起电压升高,从而导致电池整体电压和能量密度降低的问题,Goodenough首先提出用氧化物替代硫化物最为锂离子电池的正极材料,并展示了具有层状结构的LiCoO2不但可以提供接近4V的工作电压,而且可在反复循环中释放约140mA·h/g的比容量。1990年日本Sony公司以LiCoO2为正极,硬炭为负极,生产出历史上第一个锂离子电池,工作电压达到3.6V,这被认为是电池发展史上的第二个里程碑。
在接下来的1/4世纪里,锂离子电池的科研工作者和生产技术人员共同努力,在能量密度、功率密度、服役寿命、使用安全性、成本降低等方面做了大量工作。在正极材料方面开发出尖晶石型的LiMn2O4,橄榄石结构的LiFePOg,层状结构的LiNixCO1-2xMn2O2和LiNio.8Co.15Alo.05O2等可实际应用的材料;在负极方面,除了各种各样的炭材料,还开发出锡基和硅基材料:在电解质方面,聚合物电解质和陶瓷电解质等固态电解质呈现出有价值的应用前景;在电池设计和电池管理等方面也逐渐成熟起来。目前的锂离子电池已广泛应用于小型电子商品,并在电动工具,特别是电动车,以及电网储能等领域开始了应用,展现出了光明的发展前景。
1.3 锂离子电池的工作原理
锂离子电池从工作原理上看,是以两种不同的,但都能够可逆嵌入和脱出锂离子的嵌锂化合物作为电池正负极的二次电池体系,以客体粒子(锂离子)可逆嵌入主体晶格的嵌入化学为基础,嵌入和脱出反应不涉及旧的结构的破坏和新的结构的生成,反应过程中材料主体结构有较好的保持,这对于固态化学反应来说,可以使反应以很快的速度进行。
组成锂离子电池的主要部件有正极、负极、电解液和隔膜等。充放电过程中锂离子在正负极材料中脱嵌的同时,材料的晶体结构和电子结构以及材料中锂离子的周围环境不断变化。电池处于放电态时正极处于富锂态,电池处于充电态时正极处于贫锂态,负极与之相反。只具有离子电导性的电解液体系为锂离子在正负极之间的传输提供通路,同时与隔膜共同起到隔离正负极以防止电池内部短路的作用。与一般的化学电源体系-样,锂离子电池中电子导电通路与离子导电通路是分开的,即锂离子在电池内部迁移的同时,电子在外电路中传递形成充放电电流,保证了总的电荷的平衡。
锂离子电池和其他电池一样, 是通过电极材料的氧化还原化学反应来进行能量的储存和释放的,只不过在锂离子电池内部是利用锂离子在电场的作用下的定向运动来完成电荷的传递,其正负极均为化学势随着锂离子含量变化的化合物。
一般可采 用诸如图1-1的示意图来表示锂离子电池的工作原理,其中正极材料为层状过渡金属氧化物,负极为石墨,在充放电过程中发生的电化学反应如下。
负极反应: LixC
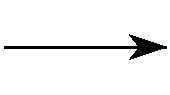
xLi++xe-+C
正极反应: MO2+xLi++xe-
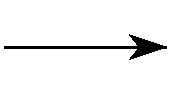
LixMO2
总反应: LixC+MO2
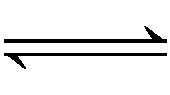
C+LiyMO2
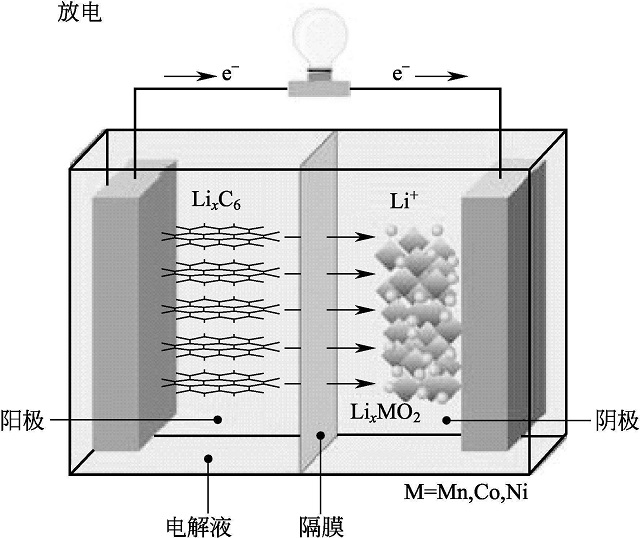
图1-1 锂离子电池工作原理示意图
在充电过程中,锂离子和电子从层状过渡金属氧化物晶格中脱出,产生一个电子空穴和一个锂空穴。产生的锂离子经由电解液,通过隔膜到达负极,嵌入到石墨层中。同时,电子通过外电路到达负极与锂离子结合。在充放电过程中,锂离子反复在正极和负极之间嵌入和脱出。
锂离子在正负极之间并不是简单地发生浓差变化,正负极也不是简单地存储和释放锂离子,因为锂离子在正负极材料中嵌入和脱出的同时引起材料中其它元素的氧化还原反应,正是这种氧化还原反应完成了化学能和电能之间的转变,通过氧化还原电势差提供了正负极之间的电压。
电极材料的电极电位须与电解液匹配:如图1-2所示,正极及负极的电化学势(μC和μA)必须与电解液的电化学窗口(Eg)相适应(μA-μC≤Eg)。当正极电化学势低于电解液的最高占据分子轨道能量(HOMO)时,在没有SEI膜存在的情况下,正极材料参加电化学反应失去电子时会引起电解液同时失去电子而被氧化,所以正极材料的电化学势μC必须高于电解液的最高占据分子轨道能量(HOMO)。同样的,为了避免电解液的还原,负极材料的电化学势μA必须低于电解液的最低空分子轨道能量(LUMO)。但在实际应用中,由于电极表面SEI膜的形成,使正负极材料有更多的选择。
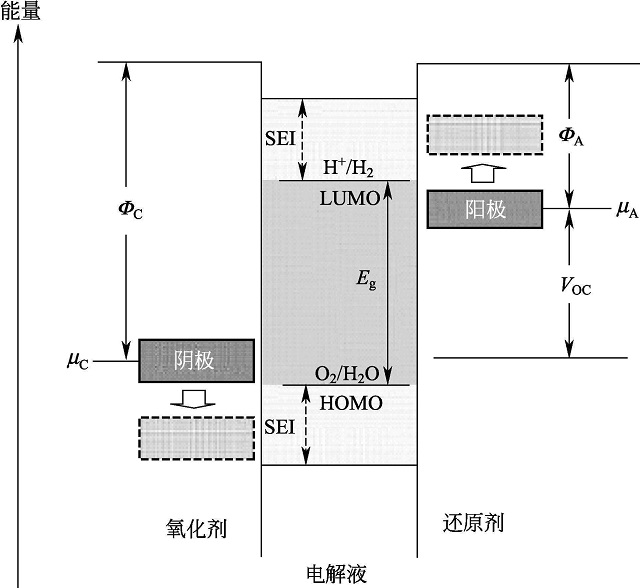
图1-2 正负极材料与电解液体系相对能量图
通常对于一个给定的电池,可以通过标准电极电势来计算实际电池正负极之间的电势差。考虑如下的电化学反应:

式中,p、q、r和s是化学物质A、B、C和D的化学计量系数。上面方程式的吉布斯自由能变化可用方程式(1-2)表示,其中a是活度。
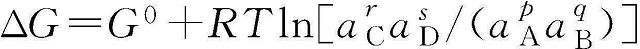
平衡状态下的电功(Wrev)是最大的可能电能(Wmax),电池发生化学反应时,可以通过吉布斯自由能的变化△G来表示。
Wrev=Wmax (1-3)
-Wmax=OG (1-4)
同时,电能与电荷Q(单位为库仑,C)和电势E有如下关系:
-Wmax=QE (1-5)
Q可用电池单元内的电子数和基本电荷电量的乘积表示:
Q=nNge (1-6)
N为阿伏伽德罗常数,NA=6.023x1023.
Q还可以用下面的方程式表示。
Q=nF (1-7)
式中,F是法拉第常数,即每摩尔电子的基本电荷数,96485C/mol。n(mol)电子在电势差的作用下在两电极间运动可用下述公式进行表达:
Wmax=nFE (1-8)
AG=-nFE (1-9)
上式表明了平衡时吉布斯自由能的变化与电池电动势之间的关系。当所有反应物和产物都处于标准状态时,标准电势用E°表示。
AG°=-nFE0 (1-10)
由方程式(1-2)和式(1-10)可导出下面的能斯特方程式,其中电势差受参与化学反应的组分的浓度的影响。
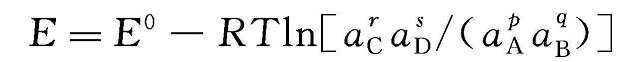
1.4 锂离子电池正极材料
锂离子电池的正极是整个电池中可嵌脱锂离子的来源,其基本要求包括:
①放电反应应该有较负的吉布斯自由能(较高的放电电压);
②基体结构的分子量要低并且能够插入大量的Li+(高质量比容量);
③主体结构的Li+扩散和电子迁移速度必须快(高功率密度);
④Li+嵌入与脱出可逆,嵌脱过程中主体结构的变化要小(长循环寿命);
⑤化学稳定性要好,无毒,价廉;
⑥材料的制备容易。
正极材料的选取首先要考虑其是否具有合适的电位,而电位取决于锂在正极材料中的电化学势μC,即从正极材料晶格中脱出锂离子的能量及从正极晶格中转移出电子能量的总和,前者即为晶格中锂位的位能,后者则与晶格体系的电子功函密切相关,这两者又相互作用。位能是决定μC的最主要因素,其次是锂离子之间的相互作用。氧化还原电对导带底部与阴离子p轨道间的距离从本质上限制了正极材料的电极电位。正极材料电位不仅与氧化还原电对元素原子的价态相关,而且与该原子同最近邻原子的共价键成分相关,氧化还原电对所处的离子环境影响该电对的共价键成分从而影响材料的电极电位。例如,Fe3+/Fe2+电对在不同磷酸盐体系中由于磷原子在不同晶体结构中对铁原子具有不同的诱导作用,使得该电对在不同的磷酸盐体系中具有不同的费米能级,即各种磷酸盐材料具有不同的电极电位[5]。
正极材料的反应机理有两类:固溶体类型和两相反应类型[6]。
①固溶体反应 锂离子嵌入脱出时没有新相生成,正极材料晶体结构类型不发生变化,但晶格参数有所变化。随着锂离子的嵌入电池电压逐步减小,放电曲线呈S形,如图1-3(a)所示。以MO2+Li++e-
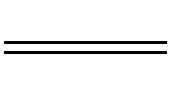
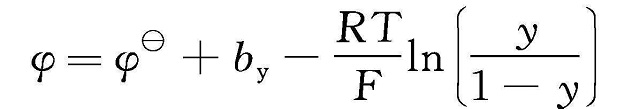
式中

--标准电极电位;
R--理想气体常数
T--热力学温度
F--法拉第常数
y--材料晶体结构中锂含量
by--嵌入晶体结构中Li+的相互作用
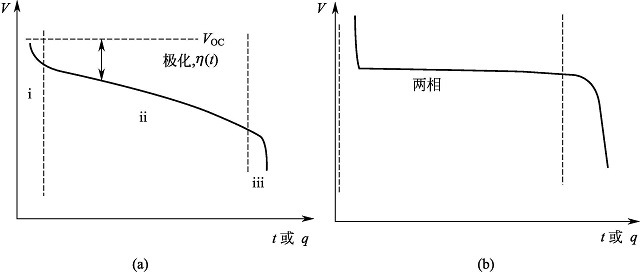
图1-3 正极材料不同反应类型放电曲线
(a)均一固相反应;(b)两相反应
②两相反应锂离子嵌入/脱出时有 新相生成,正极材料晶体结构发生变化伴随第二相生成,电池电压在两相共存区保持不变,放电后期电池电压随着活性物质消耗急剧减小,放电曲线呈I形,如图1-3(b)所示。 以MO2+Li++e-

LiMO2为例,电极电位表达式如下。
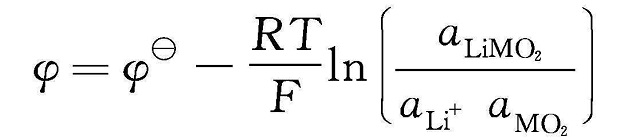
式中,a表示各种物质的活度。
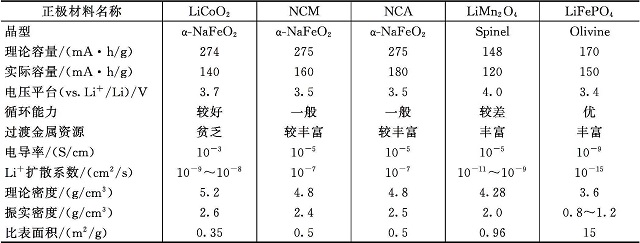
锂离子电池正极材料的研究已有40多年历史,到目前为止,据称已有二百余种锂离子电池正极材料。但真正可以实用的,也是人们研究最多的,是具有固溶体反应行为的过渡金属氧化物和具有两相反应行为的磷酸盐。常见的真正实际有生产的,也是我们将要讨论的正极材料,包括钴酸锂、镍钴锰三元、NCA材料、锰酸锂和磷酸铁锂等。
1.4.1 钴酸锂
LiCoO2是第一种锂离子电池的正极材料,在几十年的发展过程中,虽然有一些改性和提高,但基本上可以认为它是最成熟的锂离子电池正极材料。该材料具有放电平台高、比容量较高(140mA.h/g左右)、循环性能好、合成工艺简单等优点。目前它仍是锂离子电池,特别是小型锂离子电池的最佳选择。但该材料中钴元素毒性较大,价格昂贵,同时制作大型动力电池时安全性难以得到保证。
LiCoO2属于a-NaFeO,的结构,在氧离子(02)形成的立方密堆积框架结构中,CoO2和I层交替连续排列形成空间群,

Li和Co都是八面体配位。LiCoO2中Co3+的3d电子以低自旋形式存在,3d轨道中六个电子全部占据tg轨道,eg轨道全空。在充电过程中,当脱锂量小于o.5时,材料没有相变,脱锂是一种固溶体行为。同时Co3+被氧化为Co4+,伴随着从t2g轨道中脱出电子。随着锂离子的脱出,相邻CoO2层之间的静电排斥力增大,使得c轴增长。在脱锂量达到o.5时,会发生六方-单斜的相转变,这意味着,锂的排列从有序变为无序。如果再进一步充电,由于钴的t2轨道与氧的2p轨道有重叠,此时锂离子脱出时会造成氧离子的2p轨道同时脱出电子,导致氧离子脱离晶格被氧化为氧气。研究发现随着锂离子脱出量的增加,钴在电解液中的溶解量增加,严重影响LiCoO,的循环稳定性及LiCoO2电池的安全性能[8]。所以LiCoO,的充电截止电压一般为4.2V, 过高的充电截止电压,或者说过多的锂离子脱出,不仅会破
坏LiCoO2的结构,也会带来安全问题。所以LiCoO2的实际可逆容量仅为理论容量的一半左右。
LiCoO,应用的另一个问题是钴的资源问题。钴在地壳中的丰度仅为0.00259%大规模使用已经造成了钴的稀缺和价格上涨。
1.4.2 镍酸锂
由于Co的资源问题,人们最初试图开发镍酸锂(LiNiO2)来替代钴酸锂。与钴酸锂相比,锂镍氧系正极材料的实际比容量高,原材料价格低廉而且来源广泛。但人们很快就发现LiNiO2制备困难,并且热稳定性差,存在较大的安全隐患。与Co3+相比,Ni3+多一个核外电子,Ni3+的3d电子以低自旋的

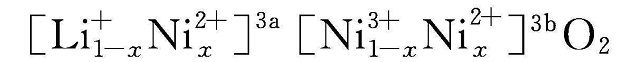
,降低了LiNiO2实际放电比容量,并且进入3a位的Ni2+在脱锂后期被氧化为半径更小的Ni3+/Ni4+导致附近晶格结构塌陷,阻碍Li+的正常可逆脱嵌,严重影响LiNiO2的电化学性能[10]。研究人员一直试图对LiNiO2进行改性以得到比容量更高的材料体系。
有研究人员发现在层状氧化物锂盐中,钴、镍、锰三种元素可以以任意比例无限互溶,利用这一特性,可以制备诸如LiNi1-xCoxO2、LiNi1-xMnxO2、LiNi1-x-yCoxMnyO2等固溶体材料。其中NMC三元材料在降低材料成本的同时,结合了钴酸锂优良的循环性能,镍酸锂较高的放电容量和锰酸锂优异的安全性能,三者的协同效应使得该材料具有优良的电化学性能。比较常见的三元材料主要有Li[Ni1/3Co1/3Mn1/3]O2、Li[Ni0.4Co0.2Mn0.4]O2、Li[Ni0.5Co0.2Mn0.3]O2等等。这一系列材料中,三种过渡金属离子的组成比例对材料的电化学性能和热稳定性有着显著的影响。如图1-4所示,可以比较明显的看到,随着镍含量的增加,虽然材料的容量增加了,但其循环稳定性下降,功率性能变差,同时热稳定性降低。 定性有着显著的影响。如图1-4所示,可以比较明显的看到,随着镍含量的增加,虽然材料的容量增加了,但其循环稳定性下降,功率性能变差,同时热稳定性降低。

图1-4 NMC系列三元材料的组成与性能比较
由LiNi1-xCoxO2掺Al发展而来的Li[Ni0.8Co0.15Al0.05]O2(NCA)材料,也可以看成是LiNiO2、LiCoO2和LiAlO2的固溶体。相对于LiCoO2材料,NCA材料在大大减少了Co的用量之后,尽管其放电电压平台要低0.1~0.2V,但容量可以达到180~210mA·h/g,综合在能量密度上仍比LiCoO2有所提高。同时由于Al的引入,提高了材料的热力学稳定性。因此被认为是一种比较稳定的高容量正极材料。日本松下用NCA作为正极材料制造的18650型电池的容量可以达到3200mA·h,在
松下用NCA作为正极材料制造的18650型电池的容量可以达到3200mA·h,在Tesla的电动车上应用成功后,这种材料得到了更多的关注。
1.4.3 锰酸锂
锰酸锂(LiMn2O4)具有较高的氧化电位,其热稳定性能比钴酸锂和镍酸锂好,耐过充。LiMn2O4为标准的立方尖晶石结构,属于Fd3m空间群,该结构中锂属于四面体配位,过渡金属元素锰是八面体配位。其尖晶石结构为锂离子的嵌入/脱出提供了良好的通道,有利于大电流充放电。
LiMn2O4的理论容量为148mA·h/g,实际容量达到120mA·h/g左右。LixMn2O4的主要电化学反应发生在4V附近,对应的x值为0<x<1,在这个范围内,材料保持立方对称,Li+脱出/嵌入没有引起非常明显的体积膨胀或收缩。因此,在3.5~4.5V电压范围,LiMn2O4具有较好的循环寿命。而在更低的电压平台3V附近,对应的x值为1<x<2,Jahn-Tell效应导致材料从立方晶系向四方晶系发生转变,即c/a值发生了较大的变化,晶体结构发生严重扭曲。晶体结构的扭曲使得材料承受微应力,导致循环时容量会迅速衰减。因此LiMn2O4的应用研究主要在4V区域内。
尖晶石LiMn2O4具有工作电压高、安全性好、价格低廉和环境友好等优点,但是在高温循环过程中,由于锰的溶解、Jahn-Teller效应和电解液的分解等问题导致容量衰减特别严重。
1.4.4 磷酸铁锂
自1997年Goodenough课题组首次报道LiFePO4作为锂离子电池正极材料以来,该材料由于资源丰富、价格低廉、环境友好、放电平台平稳而迅速成为全世界研究的热点。 LiFePO4中的阳离子排列不同于层状LiCoO2和尖晶石LiMn2O4。Fe2+处于氧八面体的4c位,Li+处于氧八面体的4a位。聚阴离子
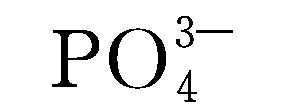
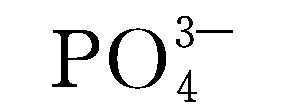
表1-1 锂离子电池正极材料的比较
1.5 锂离子电池负极材料
锂离子电池的负极是锂离子的受体。一般来说,选择一种好的负极材料应遵循以下原则:
①嵌锂电位低,尽可能接近锂的氧化还原电位;
②单位质量和单位体积的储锂本领高;
③锂在其中的嵌入脱出反应快,即锂离子在固相中的扩散系数大,在电极-电解液界面的移动阻抗小;
④电子导电性高;
⑤锂离子在电极材料中的存在状态稳定;
⑥材料在嵌脱锂离子的过程中形变小;
⑦在电解液中不溶解。
目前常见的负极材料有炭负极材料、锡基负极材料、含锂过渡金属氮化物负极材料和硅负极材料等,而真正商用的只有炭负极材料。可用作锂离子电池负极材料的炭负极材料有石墨、焦炭、中间相炭微球和硬炭等。
1.5.1 石墨
石墨来源广泛、价格低廉,是较早用作锂离子电池负极的炭材料。石墨主要有天然石墨和人造石墨两种。石墨的可逆充放电容量可达到350mA·h/g以上,接近LiC6的理论比容量372mA·h/g,此外锂在石墨中的脱/嵌反应主要发生在0~0.25V(相对于Li/Li+),具有良好的充放电平台,电压平稳。但由于石墨的结晶度高,具有高度取向的层状结构,因此对电解液较敏感,与溶剂相容性较差。另外,石墨的大电流充放电能力较差。同时,由于石墨层间距小于锂插入石墨层后形成的石墨层间化合物LixC6的晶面层间距,在充放电循环过程中,石墨层间距变化较大;而且还会发生锂与有机溶剂共同插入石墨层间以及有机溶剂的分解,容易造成石墨层逐步剥落、石墨颗粒发生崩裂和粉化,从而降低石墨材料的循环寿命。
1.5.2 焦炭
焦炭具有资源丰富和价格低廉的优势。它是经液相炭化形成的一类炭素材料,视原料的不同可分为沥青焦和石油焦等。焦炭对各种电解液的适应性较强,耐过充过放的性能较好,循环寿命较长。焦炭具有热处理温度低、成本低以及与PC相容性好等特点,因此可以降低电池成本。但由于充放电时电压不平稳,且平均放电电压较高,这对于实际电池可使用的电压及容量都是不利的。此外,焦炭的振实密度约为石墨的80%,因此体积比容量较低。
1.5.3 硬炭
硬炭是一种接近于无定形结构的炭材料,一般具有很高的可逆嵌锂容量,但缺点是电压明显滞后,即充电时锂离子在0V(vs. Li+/Li) 左右嵌入,而放电时在1V脱嵌,因此全电池体系中工作电压仅3V。另外,硬炭的循环性能较差,且能量密度不及石墨。从综合性能考虑尚不能替代石墨类材料,这使得硬炭应用于商品化锂离子电池面临着很大的困难。
1.5.4 中间相炭微球
中间相炭微球(MCMB)是研究较多的软炭负极材料。其颗粒呈球形,堆积密度较高,为高度有序的层面堆积结构,体积比能量较大。MCMB比表面积较小,可以减少在充放电过程中电极边界副反应的发生,从而降低第一次充电过程中的容量损失。另外,MCMB具有片层状结构,有利于锂离子从球的各个方向嵌入和脱出,解决了石墨类材料由于各向异性过高引起的石墨片溶涨、塌陷和不能大电流放电的问题。商品化的MCMB具有优良的循环性,是目前长寿命小型锂离子电池及动力电池所使用的主要负极材料之一。它存在的主要问题是质量比容量不高(<300mA·h/g),尤其是目前将中间相沥青炭微球作为锂离子电池电极材料使用时,需要进行2800℃石墨化处理,这无疑大大提高了中间相沥青炭微球的成本。
1.6 锂离子电池电解液
锂离子电池的电解液是一种锂盐的有机溶液,在电池内部正负极之间起着输送和传导电流的作用,它在两个电极之间架起了一座锂离子专用的桥梁。正是由于电解液从传统的水溶液体系转变成有机体系,才使得锂离子电池的电压相对之前的各种电池有了大幅的提高。对电解液的基本要求有:
①离子电导率高;
②电化学稳定的电位范围宽;
③热稳定好,使用温度范围宽;
④化学性能稳定,与集电流体和活性物质不发生化学反应;
⑤安全低毒。
目前锂离子电池所采用的有机电解液主要是以碳酸乙酯(EC)和二甲基碳酸乙酯(DMC)等为溶剂,以六氟磷酸锂(LiPF6)等锂盐为溶质,并添加适当添加剂所构成的。
目前锂离子电解质锂盐按阴离子可分为两类:不含氟的阴离子锂盐如LiClO4;含氟的阴离子锂盐如LiBF4、LiAsF6、LiPF6、LiCF3SO3等。LiClO4虽然具有适当的电导率、热稳定性和耐氧化稳定性,但LiClO4是一种强氧化剂,可能会引起安全问题而不能用于实用型电池中;LiBF4不仅热稳定性差、易于水解而且电导率相对低;LiAsF6基电解液具有最好的循环效率、相对较好的热稳定性和最高的电导率,但有潜在的毒性;LiCF3SO3对正极铝集流体有腐蚀作用。综合比较,LiPF6具有较好的综合性能,被广泛应用到锂离子电池中。由于上述的锂盐都存在着不足,各国研究者仍在不断研究寻找综合性能更好的锂盐。一方面对LiPF6进行改性;另一方面寻找替代LiPF6的其他锂盐,如二草酸合硼酸锂(LiBOB)等。
溶剂是锂离子电解液的主体成分,要求电解质锂盐在溶剂中要有足够高的溶解度和良好的离子解离度,要有良好的电化学稳定性和低的腐蚀性,宽的工作温度范围,安全性好,纯度高等特点。目前溶剂主要是以EC为主的多组分溶剂。
为了改善锂离子电池某些特性,而专门开发添加剂,添加少量的功能性添加剂能够显著改变电池的某些性能。目前,研究开发比较多的有成膜添加剂、导电添加剂、阻燃添加剂以及耐过充添加剂。
1.7 锂离子电池的发展趋势
目前锂离子电池在小型电器设备和便携式设备上已获得了广泛的应用。在这些领域,发展可无线充电的锂离子电池、实现锂离子电池的循环利用、制造能量纤维实现可穿戴等等,为未来的锂离子电池的应用提供了广阔的功能性应用发展前景。
在锂二次电池的未来应用中,中型电池和大型电池展现了巨大的潜力。储能系统被视为智能电网技术的关键部件,包括电动汽车和机器人用的电池或可储存太阳能、风能和潮汐能之类替代能源的高性能锂二次电池。
未来其他类型的锂二次电池还有微型电池和柔性电池。微型电池可用于RFID/USN、MEMS/NEMS和嵌入式医疗设备;而柔性电池则主要用于穿戴式电脑和柔性显示器。这些电池的结构控制和制造工艺将和今天我们所用的方法有显著不同。
全固态锂二次电池的发展备受期待。鉴于频繁发生的电池爆炸事件引发的大量召回,我们亟需解决当前液态电解质不稳定的问题,这可以通过应用由聚合物或有机/无机复合物组成的电解液以及开发合适的电极材料和工艺来实现。
另外值得指出的是,尽管锂离子电池被认为是绿色能源,但目前锂离子电池从原材料的开采到最终的电池生产,都在大量消耗由化石能源带来的能量。据测算,锂离子电池每提供1kW·h电,对应生产和制造锂离子电池过程中排放约70kg的CO2。因此,有一些研究人员致力于采用天然或只需要简单加工的化合物来制造锂离子电池的关键材料,期望未来的锂离子电池是真正绿色和环境友好的电池。
本文链接:https://www.nxebattery.com{dede:field.arcurl/}
诺信新闻,诺信公司新闻,锂电池行业新闻,展会新闻
上一篇:没有了
下一篇:没有了