聚合物锂电池容量衰减原因分析
聚合物锂电池具有能量密度高、小型化、超薄化、轻量化,以及高安全性和低成本等多种明显优势;并且无电池漏液问题,可弯曲变形,最大可弯曲90°左右,可制成单颗高电压,液态电解质的电池仅能以数颗电池串联得到高电压,是一种新型电池。
聚合物锂电池的高能特性,让它的未来看起来一片光明。但是,聚合物锂电池也不是完美的,这一点最大的问题关键就是它的充放电循环的稳定性。这里我们以过充电、电解液分解及自放电,总结分析聚合物锂电池容量衰减原因。聚合物锂电池在两个电极间发生嵌入反应时具有不同的嵌入能量,而为了得到电池的最佳性能,两个宿主电极的容量比应该保持一个平衡值。
在聚合物锂电池中,容量平衡表示成为正极对负极的质量比,即:
上式中C指电极的理论库仑容量,Δx、Δy分别指嵌入负极及正极的锂离子的化学计量数。两极所需要的质量比依赖于两极相应的库仑容量及其各自可逆锂离子的数目。

一般说来,较小的质量比导致负极材料的不完全利用;较大的质量比则可能由于负极被过充电而存在安全隐患。总之在最优化的质量比处,电池性能最佳。
对于理想的Li-ion电池系统,在其循环周期内容量平衡不发生改变,每次循环中的初始容量为一定值,然而实际情况却复杂得多。任何能够产生或消耗锂离子或电子的副反应都可能导致电池容量平衡的改变,一旦电池的容量平衡状态发生改变,这种改变就是不可逆的,并且可以通过多次循环进行累积,对电池性能产生严重影响。在聚合物锂电池中,除了锂离子脱嵌时发生的氧化还原反应外,还存在着大量的副反应,如电解液分解、活性物质溶解、金属锂沉积等。
聚合物锂电池过充电
1.石墨负极的过充反应
聚合物锂电池在过充时,锂离子容易还原沉积在负极表面:
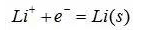
沉积的锂包覆在负极表面,阻塞了锂的嵌入。导致聚合物锂电池放电效率降低和容量损失,原因有:
①可循环锂量减少;
②沉积的金属锂与溶剂或支持电解质反应形成Li2CO3,LiF 或其他产物;
③金属锂通常形成于负极与隔膜之间,可能阻塞隔膜的孔隙增大电池内阻;
④由于锂的性质很活泼,易与电解液反应而消耗电解液。从而导致聚合物锂电池放电效率降低和容量的损失。
快速充电,电流密度过大,负极严重极化,锂的沉积会更加明显。这种情况容易发生在正极活性物相对于负极活性物过量的场合。但是,在高充电率的情况下,即使正负极活性物的比例正常,也可能发生金属锂的沉积。
2.正极过充反应
当聚合物锂电池正极活性物相对于负极活性物比例过低时,容易发生正极过充电。正极过充导致容量损失主要是由于电化学惰性物质(如Co3O4,Mn2O3 等)的产生,破坏了电极间的容量平衡,其容量损失是不可逆的。
①LiyCoO2
LiyCoO2→(1-y)/3[Co3O4+O2(g)]+yLiCoO2 y<0.4
同时正极材料在密封的锂离子电池中分解产生的氧气由于不存在再化合反应(如生成H2O)与电解液分解产生的可燃性气体同时积累,后果将不堪设想。
②λ-MnO2
锂锰反应发生在锂锰氧化物完全脱锂的状态下:λ-MnO2→Mn2O3+O2(g)
3.电解液在过充时氧化反应
当压高于4.5V 时聚合物锂电池电解液就会氧化生成不溶物(如Li2Co3)和气体,这些不溶物会堵塞在电极的微孔里面阻碍锂离子的迁移而造成循环过程中容量损失。
影响聚合物锂电池氧化速率因素有:正极材料表面积大小、集电体材料、所添加的导电剂(炭黑等)、炭黑的种类及表面积大小
在目前较常用电解液中,EC/DMC被认为是具有最高的耐氧化能力。溶液的电化学氧化过程一般表示为:溶液→氧化产物(气体、溶液及固体物质)+ne-
任何溶剂的氧化都会使聚合物锂电池电解质浓度升高,电解液稳定性下降,最终影响电池的容量。假设每次充电时都消耗一小部分电解液,那么在电池装配时就需要更多的电解液。对于恒定的容器来说,这就意味着装入更少量的活性物质,这样会造成初始容量的下降。此外,若产生固体产物,则会在电极表面形成钝化膜,这将引起电池极化增大而降低电池的输出电压。
聚合物锂电池电解液分解(还原)
一、在电极上分解
1.聚合物锂电池电解质在正极上分解:
聚合物锂电池电解液由溶剂和支持电解质组成,在正极分解后通常形成不溶性产物Li2Co3 和LiF等,通过阻塞电极的孔隙而降低电池容量,电解液还原反应对电池的容量和循环寿命会产生不良影响,并且由于还原产生了气体会使电池内压升高,从而导致安全问题。
正极分解电压通常大于4.5V(相对于Li/ Li+),所以,它们在正极上不易分解。相反,电解质在负极较易分解。
2.电解质在负极上分解:
聚合物锂电池电解液在石墨和其它嵌锂碳负极上稳定性不高,容易反应产生不可逆容量。初次充放电时电解液分解会在电极表面形成钝化膜,钝化膜能将电解液与碳负极隔开阻止电解液的进一步分解。从而维持碳负极的结构稳定性。理想条件下电解液的还原限制在钝化膜的形成阶段,当循环稳定后该过程不再发生。
聚合物锂电池钝化膜的形成
聚合物锂电池电解质盐的还原参与钝化膜的形成,有利于钝化膜的稳定化,但是
①还原产生的不溶物对溶剂还原生成物会产生不利影响;
②电解质盐还原时电解液的浓度减小,最终导致电池容量损失(LiPF6 还原生成LiF、LixPF5-x、PF3O 和PF3);
③钝化膜的形成要消耗锂离子,这会导致两极间容量失衡而造成整个电池比容量降低;
④如果钝化膜上有裂缝,则溶剂分子能透入,使钝化膜加厚,这样不但消耗更多的锂,而且有可能阻塞碳表面上的微孔,导致锂无法嵌入和脱出,造成不可逆容量损失。在电解液中加一些无机添加剂,如CO2,N2O,CO,SO2等,可加速钝化膜的形成,并能抑制溶剂的共嵌和分解,加入冠醚类有机添加剂也有同样的效果,其中以12冠4醚最佳。
成膜容量损失的因素:
①工艺中使用碳的类型;
②聚合物锂电池电解液成份;
③聚合物锂电池电极或电解液中添加剂。
离子交换反应从活性物质粒子表面向其核心推进,形成的新相包埋了原来的活性物质,粒子表面形成了离子和电子导电性较低的钝化膜,因此贮存之后的尖晶石比贮存前具有更大的极化。
通过对电极材料循环前后的交流阻抗谱的比较分析发现,随着循环次数的增加,表面钝化层的电阻增加,界面电容减小。反映出钝化层的厚度是随循环次数而增加的,锰的溶解及电解液的分解导致了钝化膜的形成,高温条件更有利于这些反应的进行。这将造成活性物质粒子间接触电阻及Li+迁移电阻的增大,从而使电池的极化增大,充放电不完全,容量减小。
二、聚合物锂电池电解液的还原机理
聚合物锂电池电解液中常常含有氧、水、二氧化碳等杂质,在电池充放电过程中发生氧化还原反应。
聚合物锂电池电解液的还原机理包括溶剂还原、电解质还原及杂质还原三方面:
1.溶剂的还原
PC和EC的还原包括一电子反应和二电子反应过程,二电子反应形成Li2CO3:
在第一次放电过程中,电极电势接近O.8V(vs.Li/Li+)时,PC/EC在石墨上发生电化学反应,生成CH=CHCH3(g)/CH2=CH2(g)和LiCO3 (s),导致石墨电极上的不可逆容量损失。
对各种电解液在金属锂电极和碳基电极上还原机理及其产物进行了广泛的研究,发现PC的一电子反应机理产生ROCO2Li和丙烯。ROCO2Li对痕量水很敏感,有微量水存在时主要产物为Li2CO3和丙稀,但在干燥情况下并无Li2CO3产生。
由碳酸二乙酯 (DEC)和碳酸二甲酯(DMC)混合而成的电解液,在电池中会发生交换反应,生成碳酸甲乙酯(EMC),对容量损失产生一定的影响。
2.电解质的还原
聚合物锂电池电解质的还原反应通常被认为是参与了碳电极表面膜的形成,因此其种类及浓度都将影响碳电极的性能。在某些情况下,电解质的还原有助于碳表面的稳定,可形成所需的钝化层。
一般认为,支持电解质要比溶剂容易还原,还原产物夹杂于负极沉积膜中而影响电池的容量衰减。几种支持电解质可能发生的还原反应如下:
3.杂质还原
①聚合物锂电池电解液中水含量过高会生成LiOH(s)和Li2O 沉积层,不利于锂离子嵌入,造成不可逆容量损失:
H2O+e→OH-+1/2H2
OH-+Li+→LiOH(s)
LiOH+Li++e-→Li2O(s)+1/2H2
生成LiOH(s)在电极表面沉积,形成电阻很大的表面膜,阻碍Li+嵌入石墨电极,从而导致不可逆容量损失。溶剂中微量水(100-300×10-6)对石墨电极性能没影响。
②溶剂中的CO2 在负极上能还原生成CO 和LiCO3(s):
2CO2+2e-+2Li+→Li2CO3+CO
CO 会使电池内压升高,而Li2CO3(s)使电池内阻增大影响电池性能。
③溶剂中的氧的存在也会形成Li2O
1/2O2+2e-+2Li+→Li2O
因为金属锂与完全嵌锂的碳之间电位差较小,电解液在碳上的还原与在锂上的还原类似。
聚合物锂电池自放电
聚合物锂电池自放电是指电池在未使用状态下,电容量自然损失的现象。聚合物锂电池自放电导致容量损失分两种情况:
一是可逆容量损失;
二是不可逆容量的损失。
可逆容量损失是指损失的容量能在充电时恢复,而不可逆容量损失则相反,正负极在充电状态下可能与电解质发生微电池作用,发生锂离子嵌入与脱嵌,正负极嵌入和脱嵌的锂离子只与电解液的锂离子有关,正负极容量因此不平衡,充电时这部分容量损失不能恢复。如:
锂锰氧化物正极与溶剂会发生微电池作用产生自放电造成不可逆容量损失:
LiyMn2O4+xLi++xe-→Liy+xMn2O4
溶剂分子(如PC)在导电性物质碳黑或集流体表面上作为微电池负极氧化:
xPC→xPC-自由基+xe-
同样,负极活性物质可能会与电解液发生微电池作用产生自放电造成不可逆容量损失,电解质(如LiPF6)在导电性物质上还原:
PF5+xe- →PF5-x
充电状态下的碳化锂作为微电池的负极脱去锂离子而被氧化:
LiyC6→Liy-xC6+xLi+++xe-
自放电影响因素:正极材料的制作工艺,电池的制作工艺,电解液的性质,温度,时间。
自放电速率主要受溶剂氧化速率控制,因此溶剂的稳定性影响着电池的贮存寿命。
溶剂的氧化主要发生在碳黑表面,降低碳黑表面积可以控制自放电速率,但对于LiMn2O4正极材料来说,降低活性物质表面积同样重要,同时集电体表面对溶剂氧化所起的作用也不容忽视。
通过电池隔膜而泄漏的电流也可以造成聚合物锂电池中的自放电,但该过程受到隔膜电阻的限制,以极低的速率发生,并与温度无关。考虑到电池的自放电速率强烈地依赖于温度,故这一过程并非自放电中的主要机理。
比较3种主要金属氧化物正极在各种不同电解液中的自放电速率,发现自放电速率随电解液不同而不同。并指出自放电的氧化产物堵塞电极材料上的微孔,使锂的嵌入和脱出困难并且使内阻增大和放电效率降低,从而导致聚合物锂电池不可逆容量损失。
本文链接:https://www.nxebattery.com{dede:field.arcurl/}
诺信新闻,诺信公司新闻,锂电池行业新闻,展会新闻