锂离子电池电解液知识及电化学测试方法
锂离子电池电解液知识及电化学测试方法。本文内容主要有以下三点:
一、锂离子电池电解液
二、锂离子电池电解液添加剂
三、锂离子电池常用电化学分析方法
一、锂离子电池电解液
·电解液是锂离子电池的重要组成部分,在电池正负极之间起着输送和传导电流的作用。
·电解液选择在很大程度上决定着电池的工作机制,影响着电池的比能量、安全性、循环性能、倍率性能以及电池成本等等。所以,锂离子电池电解液体系的优化已经引起人们极大的关注。
·锂离子电池常用的电解液是在有机溶剂中溶有电解质锂盐的离子型导体。
实用锂离子电池的电解液应具备以下性能:
·离子电导率高(高介电常数,低粘度),电子电导率低;
·电化学稳定的电位范围宽;
·热稳定性好,使用温度范围宽;
·化学性能稳定,与电池内集流体和活性物质不发生化学反应。
·安全(高闪点)、无毒、经济。
锂离子电池电解液
·锂离子电池电解液是在有机溶剂中溶有电解质锂盐的离子型导体。
·含LiPFg的有机电解液,具有较好的电导率和电化学稳定性,不腐蚀集流体。
·实际的锂离子电池电解液多采用将高介电常数溶剂与低粘度溶剂按一定比例混合而成,并加入某些特定添加剂,来满足电池对电极容量、倍率充放电、正负极匹配、循环寿命等方面的性能要求。
1.电解质锂盐
·导电锂盐在锂离子电池中起着传输离子和传导电流的作用,对电池性能有着重要的影响。合适的导电锂盐要满足许多条件,如有较好的溶解性、较高的电导率、较好的化学稳定性、较宽的电化学窗口、较高的铝腐蚀电位等,并且要使锂离子在正负极有高的嵌入量和较好的可逆性,另外成本低、无污染、无毒害也是必须要考虑的。
·按阴离子中心原子的不同划分,则可分为磷系锂盐,硼系锂盐,甲基系列锂盐,亚胺系列锂盐以及其它导电锂盐。
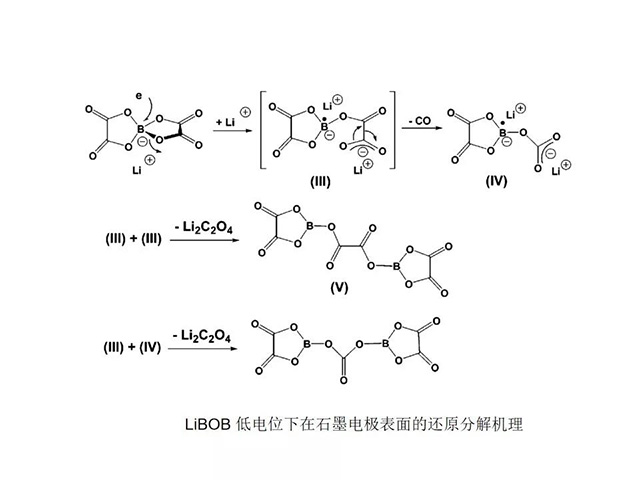
·已报道的可用于锂离子电池的锂盐有很多,大体.上可分为有机盐和无机盐。目前较常用的是无机阴离子导电锂盐,主要为LiPFg、LiBOB、LiBF4、LiTFSI等 几种;
磷系列锂盐-LiPF6
·磷系列锂盐主要包括无机锂盐LiPF6以及LiPF6中的部分氟原子为全氟烷基取代后的锂盐、有机磷酸酯锂盐等。
·LiPF6的热分解温度低,仅为30°C,易分解为PF5和LiF,但LiPF6通过纯化,溶于有机溶剂中后分解温度可达80-130°C,常温下能够避免分解以及引起的电解质聚合,0.1mol/L的LiPF6在PC中的氧化电位为6.0V,LiPF6的电导率高,25°C0.1mol/L的LiPF6在PC/DMC(1:2的体积比)溶液中电导率达到4.4Ms/cm,内阻小,可实现快速充放电,而且LiPF6碳阳极有一个相对较高的放电容量,所以目前大多数电解液都用LiPF6作为电解质盐;但LiPF6的高温性能差,而且也存在着制备过程复杂,工艺条件苛刻,遇水易分解,价格昂贵等问题。
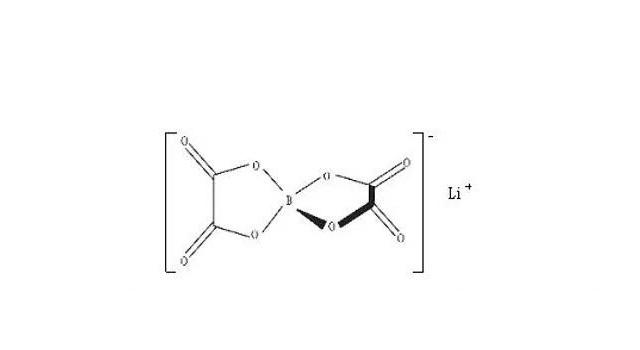
LiBOB的阴离子以硼原子为中心,呈独特的四面体结构。测试结果显示,LiBOB品体中锂与阴离子中草酸官能团的两个氧原子配位,键长大约是0.19~0.21nm,夹角O-Li-O几接近90°。同时,锂还与分属于三个不同阴离子的个氧原子相互作用(键长大约是0.21~0.30nm),形成层状的晶体结构。这种五重配位的形式使得锂很容易再结合其它分子,形成更稳定的八面体配合结构。因此,LiBOB具有很强的吸湿性,与空气接触后常以更稳定的六重配位Li[B(C20 )] H2O结晶水合物的形式存在。
[1]李世友,马培华,滕祥国等化学进展,2007年, 第19卷,第5期,695.
从LiBOB的结构不难看出,LiBOB中不含——F、——SOg和——CH,一般认为正是这几种基团导致了锂盐的热稳定性差、腐蚀铝箔集流体和低电导率。由于B同具有强烈吸电子能力的草酸根中的O相连,因此电荷分布比较分散,使阴、阳离子键的相互作用较弱,为该盐在有机溶剂中具有高的溶解度、电导率和热稳定性提供了保证。另外,LiBOB的分子量只有194,相对于另一可能的锂盐LiN (CFgSO3)2具有更高的比能量,确保LiBOB在锂离子电池中作锂盐使用。
[1]康晓丽,仇卫华,刘兴江电源技术。2008年, 32卷,11期,804.
在PC溶液中能够形成稳定有效的SEI膜
电解液的成分决定了负极表面形成SEI膜的好坏。LiPF6与EC或EC的混合物形成的电解液之所以能在锂离子蓄电池上使用,主要是首次放电过程中能在石墨电极上形成稳定有效的SEI膜,支持锂离子的插入和捅出同时阻止电解液的进一步氧化和还原,提高电解液的稳定性。
作为EC的同系物,PC的低温性能更好,但PC构成的电解液与翠不匹配,常使石墨表面分解或剥落,无法应用于锂离子蓄电池。现有研究表明,LiBOB与PC(或含PC的混合物)形成的电解液却能形成稳定有效的SEI膜,电池能够完成充放电,不会出现石墨剥落现象。
[1]李世友,马培华,滕祥国等.化学进展,2007年, 第19卷,第5期,695.
·LiBOB 在石墨电极表面具有优良的成膜性质,BOB-可在较高的负极电位(1.8V vs. Li/Li+)发生SEI成膜反应;
·红外光谱研究表明,反应首先生成LiBOB重排后的产物三角形硼酸酯(BO3)和草酸酯类化合物,.上述物质可进一步与烷基碳酸锂结合,形成的SEI膜更加均匀、致密、有韧性。
·在1 mol/L LiBF4/PC+EC+EMC(体积比为l:1:3)中添加2%的LiBOB,即可大幅提高首次充放电库能效率、循环寿命和高温循环性能。
·LiBF4/PC电解液的低温性能和大电流放电性能较好,但无法形成稳定的SEI膜,使应用受阻。S.S.Zhang[1]等发现,在LiBF4中加入少量的LiBOB ,即使在PC含量很高时也能促进SEI膜的形成,原因是LiBOB参与了SEI膜的形成。
·刘永欣等[2]人利用循环伏安和充放电循环测试,研究了负极材料(人造石墨和MCMB)与不同浓度LiBOB/PC电解液的相容性。当LiBOB浓度为1mol/L时,两种材料均能生成稳定的SEI膜;当浓度为0.5mol/L时,MCMB可生成稳定的SEI膜,而人造石墨只有在电解液含EC共溶剂时,通过EC和LiBOB的共同作用,才能生成稳定的SEI膜。这说明石墨表面生成的SEI膜,不仅与电解液的组成和浓度有关,还与石墨的种类及结构有关。
[1] ZHANG S S, XU K, JOW T R. J Power Sources, 2003, 115:137-142.
[2]刘永欣,付延鲍,马晓华等电池2006,36(5).
高温条件下容量不衰减
LiBOB与传统锂盐LiPF6、LiBF4及一些磺酰亚胺锂盐相比,还具有构成的电池在高温条件下放电容量不衰减的特点。对比不同温度下LiNiO2 / C在LiPF6/EC-DMC和LiBOB / EC-DMC电解液中的循环效率可以看出,在前50次循环过程中,两种电解液的性能相差不大。但70°C下当循环次数超过50时,LiPF6/EC-DMC电解液的能量明显下降,循环77次后放电能量只有原来的56%;而LiBOB / EC-DMC电斛液在60°C或70°C较高的温度下,直到第100个循环放电容量仍基本保持不变,库仑效率可维持约97%这说明LiBOB构成的电液在温度较高时具有非常好的性能和长时间放电能量不衰减的特点。
铝的完美钝化
·用作集流体的铝由于质量轻、耐腐蚀、成本低等特点,存锂离子电池中有着不可替代的作用。铝的保护主要是靠其表面生成的钝化膜,而非水溶液中生成的钝化膜的成分、结构主要是由溶质决定。因此,用作锂离子蓄电池的盐或电解液在高电压下不能腐蚀铝,这是它们能够得到应用的基木要求。
·例如:具有良好综合性质的LiN(CFSO3)2由于腐蚀铝,限制了它在锂离子二次电池中的使用。
[1]宋印涛,李连仲,丁静,李艳平,浙江化工.2010年,41卷, 第8期,24.
优点
除了具有优异的高温性能,能够在负极表面形成致密的SEI膜之外,LiBOB还有很多其他的优点[1]:
(1)对水相对不敏感(相对于LiPF6来讲):通过比较含水量均为1mg/L的LiBOB基和LiPF6基电解液发现,使用LiBOB电池的首次循环效率为87%,循环100次后,容量保持率为75%;而使用LiPF6电池的首次循环效率为82%,循环50次后,容量保持率仅有58%;
(2)制备所用的原料价廉易得,制备方法相对简单:基本上是以廉价的LiOH或Li2CO3、草酸、H3BO3或B2O3为原料,以水、甲苯或四氢呋喃等作为反应介质;
(3)不会腐蚀正极集流体铝箔:电化学阻抗研究表明,BOB-阴离子能在高于PF6的电位下,在铝箔上形成很好的钝化膜。
[1]康晓丽,仇卫华,刘兴江.电源技术。2008年,32卷, 11期。 804.
缺点
LiBOB存在的缺点主要有以几个方面:
(1)电导率的问题[1]
LiBOB在部分低介电常数的溶剂中(特别是线性碳酸酯类)几乎不溶解。例如,它在EC / DMC(3:7)的混合溶液中的溶解度只有0.80 mol/L,;而且LiBOB在碳酸酯混合物中的电导率小于常用的LiPF6电解液。
LiBOB电解液体系的低温性能也不如LiPF6。如1 mol/Kg LiBOB / EC-DMC溶液在-20°C时只能维持室温条件下能量的19%,而LiPF6却能维持74%。解决这些问题需要优化电解液(特别是溶剂)的组分和组成;己有研究表明,在EC-EMC中加入PC,则能显著提高LiBOB电解液的低温性能。
(2)对水分的敏感性
LiBOB对空气中的水分非常敏感,容易分解成草酸酯等物质。
(3)安全性
LiBOB所构成的电解液的安全性尚待详细地研究。已有研究表明,LiBOB与常见的金属氧化物构成的正极材料之间具有高的反应活性。而且,在使用过程中LiBOB电解液会分解产生气体。这些气体可能是LiBOB阴离子的分解产物,也可能来源于LiBOB中的杂质。气体的产生将引起电池内部压力的增加,带来不安全因素。
(4)LiBOB浓度越大,石墨负极的SEI膜电阻越高。作为电解液的添加剂,使用浓度在1%-5%之间时可以避免LiBOB不足,并改善碳负极的界面性质。
康晓丽,仇卫华,刘兴江电源技术。2008年,32炎, 11期, 804.
·LiBOB 在碳酸酯类有机溶剂中的溶解性及电导率都低于LiPF6,导致制备的电池的大电流放电性能不好。在同样的碳酸酯类溶剂体系中,LiBOB的低温性能不如LiPF6。要提高LiBOB体系电解液的性能,必须开发新的溶剂体系。
·目前,提高LiBOB溶解度的途径主要有两条:
①寻找合适的溶剂配比,使锂盐既易溶解,又不会使溶液黏度过大;
②改变提纯时的析晶温度使晶粒尽可能细。根据结晶学原理,析晶温度不同,晶体成核和长大的速度不同。对BOB-这种弱配位离子,低粘度溶剂是得到高电导率的关键。
康晓丽,仇卫华,刘兴江电源技术。2008年, 32卷,11期, 804.
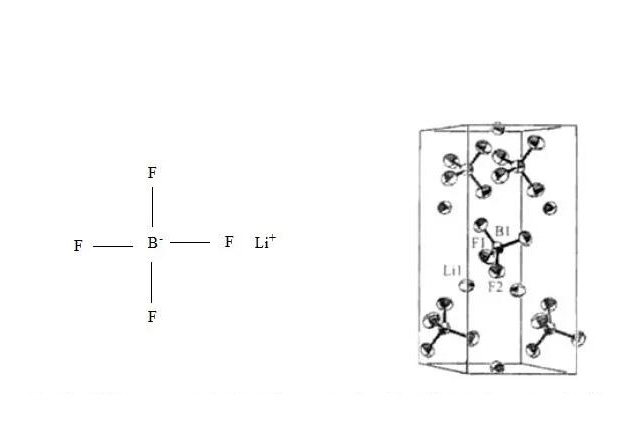
LiBF4晶体属于三方晶系的P3121空间群,Li+和周围的四个BF4-中的F配位。而与Li同系的Na的四氟硼酸化合物的配位数为8,KBF4的配位数为10,甚至LiCIO4中Li+的配位数都为6。ClO4与BF4-的空间结构都是正四面体,而且前者比后者的体积大,这就使LiBF4品体具有较大的分子单元体积。
锂离子电池LiBF4基液体电解质研究进展,张昕岳,周园,邓小宇,杜秀月,化学通报,2007,70 .(12)
·在几种常用的电解质盐中HF的含量以这样的顺序递减:
LiPF6>LiTF(三氟甲磺酸锂)>LiTFSI(二(三氟甲磺酰)亚胺锂)>LiCIO4>LiBF4,因此LiBF4有明显的优势,而且LiBF4比LiPF6稳定;
·LiBF4对环境水分不是太敏感,热稳定性比LiPF6强,毒性没有LiAsF6大,安全性比LiCIO4高,而且LiBF4能有效的防止AI集电极的腐蚀(AI由于密度小、能形成一层表面氧化膜,这使得其能承受较高的电压,从而使其广泛地作为锂离子电池阴极集电极) ;
·但是LiBF4的离子电导率较低,而且单独使用LiBF4时不能在碳负极上形成稳定的SEI膜。
锂离子电池LiBF4基液体电解质研究进展,张昕岳,周园,邓小宇,杜秀月,化学通报,2007,70 (12)
·与其他几种常用的电解质盐相比较而言,具有较小的体积,因此LiBF4有机溶液体系的粘度较小,但LiBF4只具有中等的离子电导率;由此可知溶液的粘度并不是决定电解质溶液电导率大小的唯一因素。可能是因为体积较小,与Li+的结合紧密,使LiBF4难以解离,导致其电导率降低。
·电解质电导率的大小在一定程度上取决于锂盐形成离子对的难易程度,将电解质盐溶解在既有高介电常数(可以促进电解质盐的解离)又有低粘度(有利于离子的迁移)的有机溶剂中可以提高电解质的电导率。
锂离子电池LiBF4基液体电解质研究进展,张昕岳,周园,邓小宇,杜秀月,化学通报,2007,70 (12)
·BF4-的负电荷大于PF6-,因此更容易与Li+形成紧密的离子对,这使得LiBF6比LiPF6更难解离。因此可以通过添加与Li+的结合能力比BF4-强的Lewis碱如磷酸三甲酯(TMP)等来取代与Li+结合,从而促进LiBF4解离。
·过程可以用方程式来表达:
(Li+-BF4-)+Lewis base (Li+>Lewis base)+ BF4-
·由于BF4-难以解离,LiPF6中Li+的溶剂化数目约为LiBF4中Li+的溶剂化数目的两倍,而且LiPF6中Li+与PC桥连在一起,使得LiPF6/PC体系的粘度远大于LiBF4/PC体系。
1.低温环境的应用
(1)在低温下,电解质的离子传导率可能不是限制锂离子电池性能的主要因素;
(2)LiBF4基电解质具有较小的电荷转移电阻;
Zhang和Xu[1]等报道的将LiBF4溶解在PC / EC / EMC(质量比1: 1: 3)有机溶剂体系中组成的电解质,直到温度降低到-40°C都表现出了良好的性能。但LiBF4基电解质体系具有较高的凝聚温度,如果不解决这个问题,这将在很大程度上限制其使用的低温下限。
Jow等[2]认为通过选择溶剂体系,找到介电常数和粘度的平衡点,可以开发出可用于较宽温度范围的LiBF4和双乙二酸硼酸锂(LiBOB)基的电解质体系。
[1] ZHANG S S, XU K, JOW T R.2003, 115:137-142.
[2] T R Jow, M S Ding, K Xu et al. Journal of Power Sources, 2003, 119-121:343~348.
2.高温环境的应用
高温性能对于锂离子电池来说也是需要解决的问题之一。LiBF4热稳定性比LiPF6要好,这使得有可能将其用于高温环境下。如果采用LiBF4基电解质体系,当温度高于80°C时,锂离子电池不仅容量迅速下降,库仑效率也大大下降,而且这些损害即使将锂离子电池再次置于常温下都是不可修复的[1]。
这可能是由于电解质与电极材料发生了反应,而导致容量下降。但在此温度下LiBF4本身还是稳定的。因此电解盐的稳定性不是决定电解质体系在高温下稳定性的唯一决定因素。虽然目前开发高温下LiBF4基电解质体系没有统一的理论指导,人们还是进行了很多实际的尝试。
[1] S S Zhang, K Xu, T R Jow. J. Electrochem. Soci., 2002, 149 (5): A586-A590.
Norio等人[1]发现对于LiCoO2正极材料,当采用LiBF4. EC / GBL电解质体系时,直至85°C都表现出了较高的库仑效率和能量密度以及较好的稳定性。碳酸亚乙烯酯(VC)的加入使锂在高温下的循环效率得到了极大的提高[2]。
一直以来人们都很少采用两种电解质盐的混合体系,因为这样做效果通常都不太明显,但有趣的是当将LiBF4和LiBOB混合使用时,Li/LiFePO4电池体系的性能得到了很大的改善,而且这种电池体系有可能在一50°C到80°C的温度范围内使用[3]。
[1] T Norio, O Takahisa, H Hiroyuki et al. J Electrochem, Soc., 2002, 149(1): A9~A12.
[2] H Ota, K Shima, M Ue et al. Electrochimica Acta, 2004, 49(4): 565-572.
[3] S S Zhang. K Xu, T R Jow. J Power Sources, 2006, 159(1): 702-707.
要开发LiBF4基电解质体系,首先有几个问题必须弄清楚:
·决定LiBF4的电导率的因素有哪些?
·在特定的环境下哪些因素是决定性的?
·为什么其不能在碳负极表面形成稳定的SEI膜?
·为什么在温度升高而LiBF4本身在这个温度范围内还稳定时,电解质体系就变得不再稳定?
·由于LiBF4对HF较为敏感,因此如何防止其释放出HF也是一个需要解决的问题。
锂离子电池LiBF4基液体电解质研究进展,张听岳,周园,邓小宇,杜秀月.化学通报,2007.70 (12).
开发LiBF4基电解质体 系将主要集中在以下这些方面:
·具有中等体积的阴离子对于改善电导率是非常有帮助的,开发新的具有中等体积的LiBF4的衍生物如Li[CnF2n+1BF3]和LiODFB引等是很有吸引力的,后者既有LiBF4的优点又具有LiBOB的优点,开发新的具有中等体积的LiBF4的衍生物这个领域将会吸引越来越多研究者的目光。
·改进溶剂体系依然是很有吸引力的-一个研究方向,因为对溶剂体系的改进不仅可以改善电导率而且还可能利用电解质盐的其他一些优点。在电解质体系中从来不会缺少添加剂的身影,它将继续起着弥补锂离子电池不足之处的作用,因为这种方式不仅简单而且有效。
锂离子电池LiBF4基液体电解质研究进展,张听岳,周园,邓小宇,杜秀月.化学通报,2007.70 (12).
二氟草酸硼酸锂-LiODFB
·二氟草酸硼酸锂,其阴离子结构结合了LIBF4,LIBOB阴离子的结构各一半,因此结合了两者的优势,LIODBF基电解液在宽温度范围内具有优良的离子导电性,高电位下可以使铝箔流体完美钝化,当用于PC溶剂中时支持石墨的循环性能,与BOB同样具有很好的高温性能,在石墨负极形成的SEI膜与BOB相比,阻抗相对较小,可以避免因此带来的功率密度降低的缺陷。
·在链状碳酸酯溶剂中的溶解度较大,而且在负极表面形成稳定的SEI膜,从而有效保护负极不受电池中其他组分的破坏,同样在PC溶剂中形成稳定的SEI膜,由于ODFB具有LIBF4的部分结构,所以低温性能有所提高,并且不像LIBOB对杂质和水分那么敏感,研究表明,ODFB及电解液性能良好,而且用作添加剂时同样表现出无可比拟的优良性能。
甲基系列锂盐
·该类锂盐主要是含有CF3SO2基团的盐,如LiC(CF3SO2)3,LiCH(CF3SO2)2,LiCF3SO3等,由于在阴离子中引入了-F,-SO2吸电子基团,阴离子半径较大,使得锂盐的热稳定性和电化学稳定性,水解稳定性有了很大的提高。
·其中LiC(CF3SO2)3的各项性能较好,熔点为271-273℃,热分解温度高达340°C以上,为目前有机电解质锂盐中稳定性最好的锂盐;其电导率比其他有机锂盐都要高,在1.0mol/L电解质溶液中可达1.0x10-2S/cm。其EC/DMC电解质在-30°C都不发生凝固,且在此低温下电导率还在10-3S/cm以上,这主要归结于它的离子半径较大,其阴离子半径在目前所见电解质盐中最大,故较易电离,对正极集流体有较好的稳定性,氧化电位为5.3V.
甲基系列锂盐
·从循环性能和稳定性考虑,LiCFgSO3很具吸引力,它同LiPF6相比,热稳定性好,在碳阳极上可以提供一-个较稳定和较高的放电容量,LiCF3SO3很适用于碳纤维材料阳极,含有LiCF3SO3溶剂的缺点是导电性差,其电导能力只是相当于LiPF6的一半,这就限制了它的广泛应用,而在PC/DME(体积比1:2)溶剂中,浓度为0.1mol/L,室温下电导率达到2.3Ms/cm,且有较高的抗氧化电位4.8V,但是在锂电池正常使用电位时,含LiCF3SO3的电解液铝腐蚀电位仅为3.1V,发现铝电极表面钝化很差,因此这类盐不能用于以铝作阴极集流体的锂电池。
·另外,LiCH(CF3SO2)2用作锂离子电池的导电锂盐时表现出较好的性能,对其衍生物进一步研究,有可能获得性能较好的导电锂盐。
亚胺系列锂盐
·该类锂盐包括了含CF3SO2-的亚胺锂盐,以及含氟烷氧基的亚胺锂盐,对比研究了一系列的含有机氟亚胺锂盐的特性,指出它们具有较好的溶解性,电导率和氧化电位等,并指出高氧化电位是由于阴离子具有低的前线分子轨道能级,还原稳定性通过最低空轨道能级预测。亚胺锂盐亦可能够用与电池中的循环寿命性能优于LiPF6,含有[(CF3)2CHOSO2]2NLi的电池具有最好的循环性能。XPS分析显示亚胺锂盐电池的阳极表面为亚胺组分所覆盖。
亚胺系列锂盐- LITFSI
·研究最多的是LiN(CF3SO2)2(即LITFSI),它具有和LiPF6相近的电导率,氧化稳定性和热稳定性,而且不易水解,同LiCF3SO3相比,它具有很好的稳定性。其熔点为236-237℃,电导率为4.0x10-3S/cm.LITFSI被认为是高度石墨化电极MCMC中间相碳微球的最具吸引力的电解质锂盐,即使在反复循环时,它都能够确保稳定的几乎接近最大容量的放电能量,
但LITFSI基有机电解质应用于锂电池时,存在对铝或者铜电极集流体的腐蚀作用,在1mol/L LiTFSI/EC+DMC电解液中,Al在3.5V时发生大量缺陷而腐蚀,根据交流阻抗分析,LITFSI电解液体系在负极充电时,负
极与电解液之间保持稳定的阻抗,表明负极表面生成了均匀的钝化膜。LITFSI对正极集流体有较好的稳定性,如它在EC+THF电解液体系中,对铝集流体的腐蚀在4.4V以上。
·含多氟烷氧基亚胺盐的结构同Li(CF3SO2)2N相似,只是取代基不是多氟烷基Rf,而是多氟烷氧基RfO,其化学稳定性和热稳定性均很好,在PC/EC(1:2)混合溶剂中,甚至在浓度为0.01mol/L左右时,该电解液仍具有月1.7x10-3S/cm的电导率。
·Li(C2F5SO2)2N和Li(C4F9SO2) (CF3SO2) N等具有多氟烷基的亚胺锂盐,在铅电极上电位分别到4.5V和I4.8V也不溶解,表明铅电极在含Li(C2F5SO2)2N和Li(C4F9SO2) (CF3SO2) N的电解液中被很好的钝化,使用Li(C2F5SO2)2N制 备的电解液具有较好的循环性能,含有Li(C4F9SO2) (CF3SO2) N的EC/DMC电解液与其它锂盐相比,具有阻止电解液被氧化的功能。
其它锂盐
·LiCIO4是研究历史最长的锂盐,有适当的电导率,热稳定性和耐氧化稳定性;因为它本身是一种强的氧化剂,可能会引发安全问题,而不能用于实用型的电池中。
·LiAsF6基电解质具有最好的循环效率,而且较易纯化,有相对较好的热稳定性和几乎最高的电导率,与LiPF6相近。 然而其中的As有毒性,限制了它的应用。
·还有一些锂盐,本身电导率不高,如LiF,CF3CO2Li,C2F5COOLi等,但是加入一些能捕获阴离子的添加剂,从某种程度上而言生产了另外一种锂盐,从而促进锂盐的离解。如在LiF电解液中加入三(五氟苯基)硼烷或三(五氟苯基)硼酯,在DME中的室温电导率高达6.8x10-3S/cm,LiF的浓度可高达1mol/L,对于三(五氟苯基)硼烷和三(五氟苯基)硼酯而言,前者的热稳定性,电化学稳定性均比后者好,同时容量保持率优于后者。
锂盐总结
·各个系列导电锂盐中的有机配合物锂盐,大多是引入强吸电子性的氟原子及磺酸基,或引入芳香基,增大阴离子体积,使整个阴离子电荷趋于更分散,降低了晶格能,使其溶解度增大,从而提高锂盐的热稳定性,电化学稳定性和水解稳定性。如果阴离子体积过于庞大,锂盐的溶解性就会降低,相应的电导率也会降低,+6价的磷元素就受此影响。但磷系列锂盐的LiPF3(C2F5)3各项性能都较好,选择与之相应的有机溶剂,以提高电池的性能,是导电锂盐研究的热点之一。
·亚胺系列与甲基系列锂盐中的LiN(CF3SO2)2和LiCF3SO3很具吸引力,但都存在着对正极集流体铝箔的腐蚀作用,同时氟烷基的存在,制备成本高,这就限制了其应用。
·从锂盐自身方面来说,重点是控制阴离子的结构,如发现新型的巨型有机阴离子锂盐和聚合物锂盐,并且对已有的导电锂盐的改进,或者利用其他方法来提高电导率;从锂盐的应用方面来说,两种或多种锂盐的搭配使用,扬长避短,可以提高电解液的电导率,改善SEI膜的形成,这将成为导电锂盐的研究方向。
二、锂离子电池电解液添加剂
·SEI成膜添加剂
·抗过充添加剂
·阻燃添加剂
·稳定添加剂
·除酸除水添加剂
·浸润性添加剂
SEI成膜添加剂分类
·无机成膜添加剂
SO2、CO2;Li2CO3;KCIO4,NaCIO4;
·有机成膜添加剂
环状不饱和碳酸酯;
含硫有机成膜添加剂;
卤代有机添加剂;
其他有机成膜、饰膜添加剂:
SEI成膜添加剂
·锂离子电池的极性非质子溶剂,在电池首次充放电过程中不可避免地要在碳负极与电解液的相界面上反应,形成覆盖在碳负极表面的钝化层,人们称之为固体电解质相界面膜,简称SEI(solid electrolyte interphase)膜。
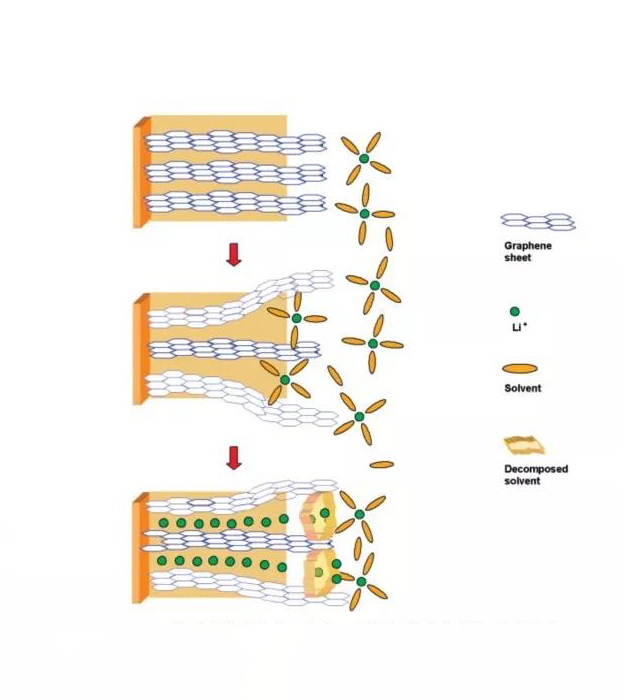
溶剂化锂离子在石墨层间分解示意图
K Xu. Chem. Rev, 2004, 104: 4303-4417.
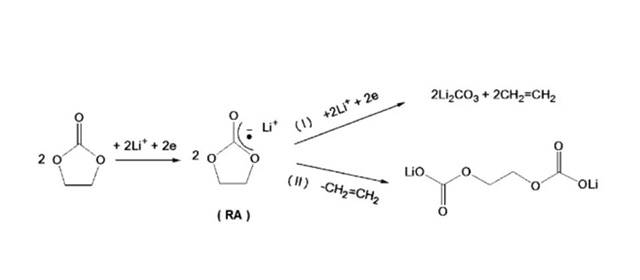
EC的还原分解
·机理I:主要产物为Li2CO3及其他气体
·机理II:主要产物为烷氧基锂,形成的SEI膜较致密且产气量少
·两种反应机理在成膜过程中同时存在,并受石墨表面形态和化学性质影响
S. S. Zhang. Journal of Power Sources,162 (2006) 1379-1394
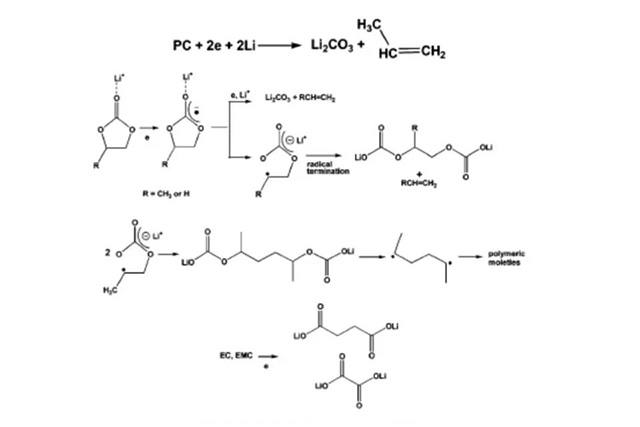
PC等碳酸酯在负极的还原分解
K Xu. Chem. Rev, 2004, 104: 4303-4417.
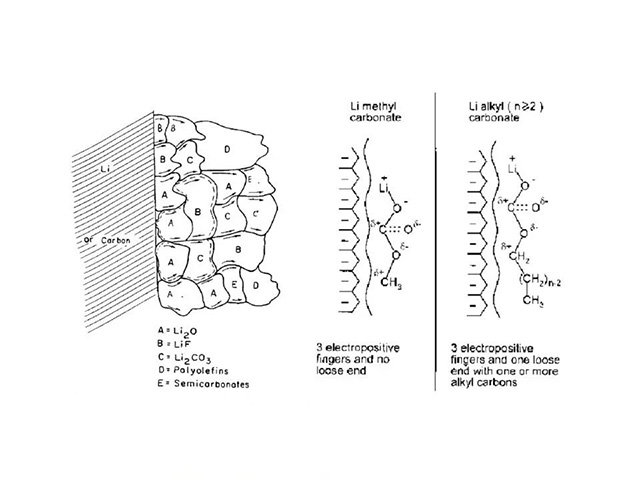
SEI膜结构示意图
K Xu. Chem. Rev, 2004, 104: 4303-4417.
·优良的SEI膜不溶于有机溶剂,致密,热稳定性和化学稳定性好;能够在允许锂离子自由进出电极的同时阻止溶剂分子穿越,从而抑制溶剂分子共插对电极的破坏,提高电池的循环效率和可逆容量等性能。
·SEI成膜添加剂多是选用还原分解电位较高的化合物,它们在首次充放电的过程中能够先于电解液的其他溶剂成分分解,在负极表面形成稳定的SEI层,从而避免和减少电解液的还原分解。
·早期:试错法
·近年来:半经验法
最低未占据轨道能级(LUMO)-还原电位
特殊基团的影响: -C C-/苯基/卤素/硫取代;
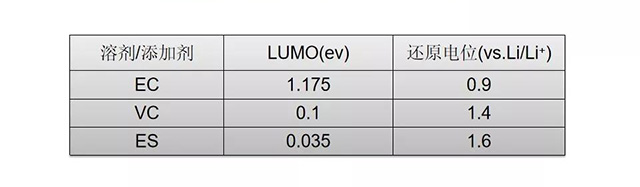
K Xu. Chem. Rev, 2004, 104: 4303-4417.
无机成膜添加剂
·早期的研究主要集中在小分子无机物如SO2、CO2 等;D.Aurbach[1]提出,加入少量CO2能够在负极材料表面形成稳定
的Li2CO3钝化层,该层被证实能有效改善锂离子电池的循环性能。
·Y.EinEli[2]等发现,在LiAsF6/PC+DMC的电解液体系中加入约20%的SO2,电化学过程中能够生成包含Li2S以及其他Li-S-O化合物(包括:Li2S2O4、Li2SO3,以及Li2S2O5,等)的钝化层;但是SO2在高电位下与正极材料相容性差;而且SO2有毒,污染环境,难以在实际生产中使用。
[1] Aurbach D, Eineli Y, Chusid O, et al. J Electrochem Soc, 1994, 141(3): 603-611.
[2] EinEli Y, Thomas S R, Chadha R, et al. J Electrochem Soc, 1997, 144(3): 823-829.
无机成膜添加剂
·碳酸锂是SEI膜的重要化学成分,也可以作为有机液体电解质的成膜添加剂使用。Shin[1]等在1 M LiPF6/PC + DMC体系中添加饱和碳酸锂,发现首次充电过程中不可逆容量降低,并且气体总量明显减少。然而碳酸锂在有机溶剂中的溶解度低,对电解液性能的改善作用有限。
·高氯酸钾和高氯酸钠作为电解液添加剂,可改善了石墨负极材料在1MLiCIO4/EC+DEC电解液中的电化学性能[2,3];在电极充电过程中,钾离子和钠离子先到达石墨负极表面,并在电极双电层附近聚集,形成一层固体高氯酸钾和高氯酸钠的保护膜,阻止了电极表面溶剂化锂离子的嵌层反应。
[1] ShinJ S, Han C H, Jung U H, et al. Journal of Power Sources, 2002, 109(1): 47-52.
[2] Zheng H H,Fu Y B, Zhang H C, et al. Electrochem Solid State Lett, 2006, 9(3): A115 -A119.
[3] Komaba S, Iltabashi T, Kaplan B, et al. Electrochemistry Communications, 2003, 5(11): 962-96
有机成膜添加剂
·环状不饱和碳酸酯:碳酸亚乙烯酯(VC)和碳酸乙烯亚乙烯酯(VEC)
·VC是在商品化锂离子电池中使用做多的成膜添加剂1.2),具有同PC、EC相似的分子结构,但是由于含有不饱和双键,化学性质要比PC和EC活泼,放电过程中能够在高于PC和EC分解电位下断开双键,生成大分子的网络状聚合物参与SEI层的形成,加之对正极材料(LiNiO2和LiMn2O,)不存在负面效应,得到了实用化的推广。它在工业中的使用量一般不超过2%,能够有效降低锂离子电池首次容量损失,改善高温下SEI层的稳定性,提高循环寿命。
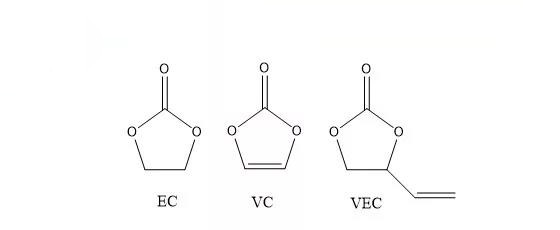
[1]兵本俊一,安部浩司等,PCT/JP01/03270 (2001).
[2] Hitoshi Ota,a,* ,Z Yuuichi Sakata, Journal of The Electrochemical Society,151 (10) A1659-A1669 (2004).
VC在石墨负极表面的还原反应
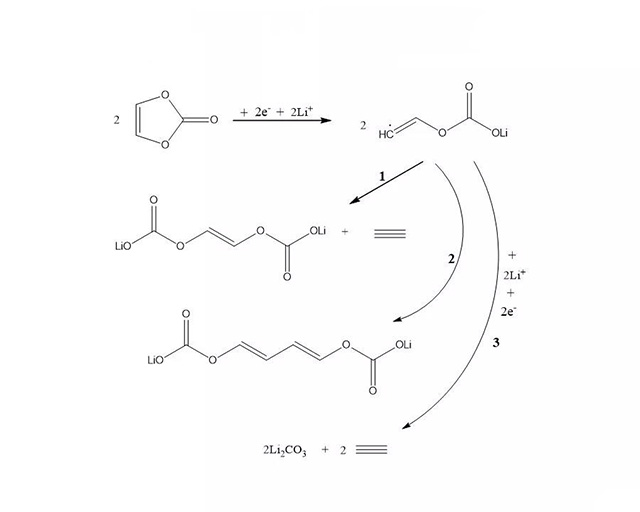
D. Aurbach , K. Gamolsky, Electrochimica Acta., 47 (2002) 1423- -1439.
VC含有C=C,其还原产物会发生聚合生成聚烷氧基碳酸锂化合物,这种高分子网状物有韧性,在电极表面稳定性好,对电池性能的改善效果更加明显。
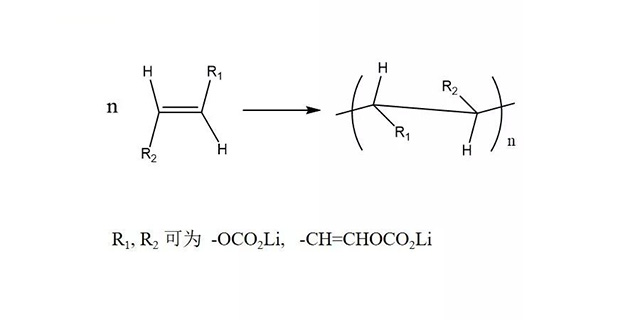
D. Aurbach , K. Gamolsky, Electrochimica Acta., 47 (2002) 1423- -1439.
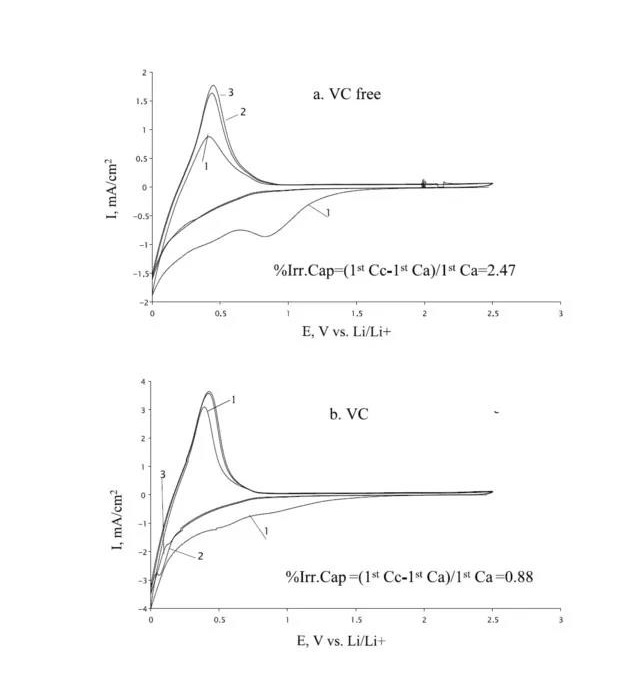
由图a, b可以知:25°C EC的还原峰在0.8V左右;VC的还原峰在1.0V左右。
石墨电极在1 M LiAsF6 EC-DMC 1:1/溶液中的前三次循环曲线25°C, 1 mV s-1.
a:不加VC
b:加5% VC
D. Aurbach , K. Gamolsky, Electrochimica Acta, 47 (2002) 1423- -1439.
·以LD-124型电解液为例,配置含有0%,0.5%, 1%,2%VC的四款电解液,组装成软包电池,经预充,老化,化成,分容后经行常温性能测试。
·测试结果:添加剂的加入有利于提高锂离子电池的放电平台,当VC的含量为1%时,提高最为明显,而此时电池容量的保持率最优。此外,VC的加入对锂离子电池高温循环寿命有显著提高,低温放电性能和低温容量保持率也达到最佳水平。
·1 mol/ L LiPF6/ EC + DEC + DMC(体积比1: 1: 1) +1%VC
·锂离子电池在低温条件下的电化学行为,发现随着温度的降低,电池的放电性能变差,放电平台降低,放电容量较室温时有所降低;随着循环的进行,容量持续衰减。将电池在低温下循环若干次后,重新在室温下进行测试,容量也不能恢复到初始值;向电解液中加入一定量的VC,可提高负极界面的导电性与稳定性,提高电池的低温放电性能。在-20°C下放电,电解液中加VC的电池的放电电压平台比不加VC的电池提高约25%。
·三电极实验结果表明:在低温下由于电池阻抗增大,极化增强,充电过程在负极出现金属锂沉积;金属锂与电解液发生还原反应形成SEI膜,SEI膜的状态与充电电流有关。
·VEC具有较高的介电常数,较高的沸点和闪点,有利于提高锂离子电池的安全性能。VEC在1.35V开始分解,能在片状石墨上形成稳定和致密的SEI膜,有效地阻止PC和溶剂化锂离子共同嵌入石墨层间,将电解液的分解抑制到最小程度,进而提高锂离子电池的充放电效率和循环特性,化学性质稳定。在锂二次电池中作为高反应活性的成膜添加剂。
·VC用作成膜添加剂具有许多优异的性能,几乎是目前已报道的最佳成膜添加剂。但是,VC不稳定,比较容易聚合,而VEC比VC稳定。这是因为VEC与VC相比,其分子结构,多一个富电子的碳碳双键,因此不易与双键发生化学反应。然而,酯基团与乙烯基的直接结合使VC处于失电子态,所以非常容易与双键发生化学反应。
·一般认为:VEC在不同的电流密度下将采用不同的还原路线,即:电流密度小时的单电子路线以及电流密度较大时的双电子路线,这是因为当电流较低时,为平衡锂离子的正电荷而出现的那些活性负电荷,它们的存在时间难以支撑两个电子迁移所需要的时间,所以VEC此时只能采用单电子的还原模式;同理,如果电流大到能够为反应提供充分的负电荷时,VEC则更倾向于采用双电子的还原模式,两种路线将形成不同的终产物,其中单电子还原多形成ROCO2Li大分子等,而双电子还原则多形成L2CO3。
·根据热力学计算得到的反应势垒,也证明了VEC较EC,PC等电解液成分更容易还原形成稳定的Li2CO3层,尽管现在人们对VEC机理的理解没有统一的说法,但是VEC作为Li+电池添加剂的正面意义都给予了肯定:即帮助形成了稳定的SEI层,有效阻止了C从电极表面脱落的现象。
·以1M LiBETI (双三氟甲烷黄酰亚胺锂) /PCIVEC (95:5 v/v)为基础电解液配方,主要对VEC的成膜作用、机理及膜组分进行了研究。
·实验表明:VEC可以很好的抑制PC的共嵌以及石墨的脱落。在CV图中可以明显的看到开始于1.35V、中心位于1.06V的还原电流峰,该电流峰即为VEC还原分解所生成。
此外,电解液中加入VEC,可使电池具有很好的循环性能:第1、2、30周循环的库仑效率分别为85%、98%、97.8%,表明在碳负极表面生成的保护膜致密稳定。FTIR、 XPS结果表明,VEC还原分解生成的钝化膜的主要成分为LiORCO2ROCO2Li, Li2CO3, LiROCO2Li,(ROCO2Li)2等(R代表烷基)
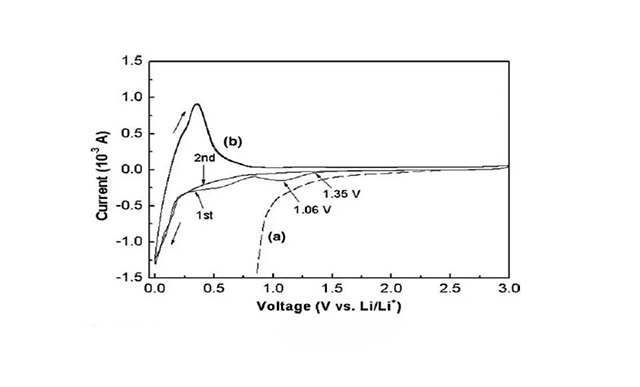
以MCMB为负极、Li1.1[Ni1/3Co1/3Mn1/3]0.9O2为正极、1.2M LiPF6,EC:PC:DMC(1:1:3,质量比)为电解液基础配方,添加0.5wt% 的VEC后,可以改善SEI膜的性能,从而抑制石墨负极的分解,并提高电池循环及高温保存时的容量保持率。例如55°C下,电池以C/2恒流充放电循环测试的结果表明: 100周 循环后,未加添加剂的电池容量损失了23%,添加0.5wt%VEC的容量保持率分别为85%。同比实验表明,如果增加VEC的加入量,应该可以得到更好的容量保持率。但是,如果VEC加入量太大,电池内阻会显著增加,比未加添加剂时高许多倍。
·在基础电解液中同时加入VC、VEC, 总量在0.05~ 5wt%比较合适。
·实验表明:常温500周循环容量保持率达80%,80°C 200h储存后厚度仅增加2mm,还可以有效的抑制循环过程中气体的产生。
·机理分析:VEC的加入之所以能够提高充放电特性,是因为VEC能够在负极活性物质的表面生成一层对锂离子的传导性高的负极覆膜;之所以能够提高充放电循环寿命特性,可以认为是由于所生成的覆膜的稳定性高,能抑制非水溶剂的还原分解反应。进而,由于该覆膜即使在高温下也能保持高的稳定性,因此可以认为,它能抑制由于非水溶剂的还原分解反应而导致的气体的产生,并且即使在高温放置时也能抑制由于内压上升所导致的电池膨胀。
VEC改善高温循环性能
·VEC不仅能改善石墨材料在PC基电解液中的电化学性能,而且对正极材料在高温下的循环性能也有一定的提高。
·Yang等[1]发现将2%的VEC加入LiPF/EC+DMC电解质中在50°C高温下将显著改善LiNi0.8Co0.2O2正极材料的循环性能。在100次充放电循环后,所保留的放电能力可以从68.8%提高到84.8%。
·差分电化学质谱的测试结果表明:在50°C下加入VEC可使得首次放电过程电池中CO2的释放量显著减少,并在第二次充放电循环时消失,这说明了阴阳两极在VEC的参与下都形成了稳定的SEI层。
[1]Jie Li,Wanhao Yao, Ying S. Meng, and Yong Yang. J. Phys. Chem. C 2008, 112, 12550-12556
·美国专利报道在电解液体系中加入VEC,可以改善高温充放电循环性能,抑制高温条件下的自放电。其中,VEC的最佳加入量为0.05~2%(v:v)。上述电解液体系中,除了VEC,如果同时加入VC,则其低温放电性能、常温循环性能也将得到改善。
·对于31%EC+5%GBL+62%PC+1%VEC+1%VC+1.0mol/L LiPF6(或1.5mol/LLiBF4)的电解液,电池在45°C下循环200周后、-10°C下放电的容量保持率分别为81%(或82%)、64%。专利指出,各添加剂的加入量需满足: 0.1SVECNC≤2% (v:v) ,如果VEC+VC>6%,则高温储存及首次充放电过程中产生的气体将增加、或负极界面处电阻增大,从而降低电池的低温放电性能;同样,VEC>2%将引起负极界面处电阻增大,进而影响低温性能。
·VEC具有较高的介电常数,较高的沸点和闪点,有利于提高锂离子电池的安全性能。
·中国某专利报道,以EC/DMC/PCNC基准电解液中另加入0~5%的VEC和0~5%的BP。经检测,该电解液的特点:
①适用性能强,可以适用于变化的体系,如042025软包装、053048方型以及043048方型的电化学体系;
②一充一放效率不低于现有电解液;
③循环性能良好,能够满足400次大于80%的要求;
④不改变电池的其它安全性能。分别通过了过了2C 5V的过充实验和1C 12V的过充实验。
·但是,要安全的通过这些过充实验,VEC和BP必须配合使用,否则仅依靠BP是无法通过的。
卤代有机添加剂
·卤代有机成膜添加剂主要包括氟代、氯代和溴代有机碳酸酯、卤带代EC,三氟甲基亚磷酸(TTFP),氯甲酸甲酯,溴代丁内酯(Br-BL)及氟代乙酸基乙烷都属于这类添加剂。
·上述添加剂借助卤素原子的吸电子效应提高中心原子的得电子能力,使添加剂在较高电位下在负极表面还原并生成有效的SEI膜。
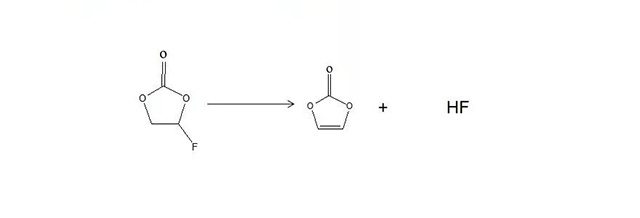
FEC氟代碳酸乙烯酯
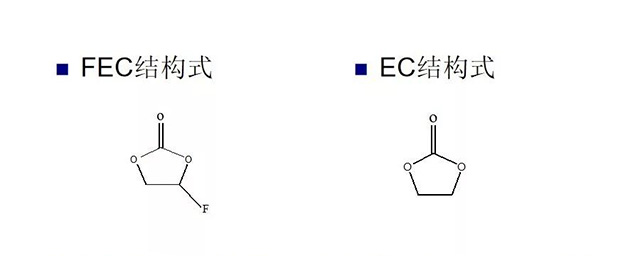
从结构上来看,FEC比EC多了一一个-F取代基团,此基团有很强的吸电子能力,因此可以解释在较高的电位下,FEC即可发生还原分解反应。由EDS(能量散射光谱)分析知,添加FEC后,MCMB电极表面面的SEI膜的主要成分元素有C、O、F,其中的F应是来白FEC的分解。
·徐康文献指出,在PC、EC的甲基或亚甲基的位置处引入-CI、-F等官能团可以得到一系列新型的碳酸酯溶剂。卤素原子的引入使得该类溶剂的熔点降低,闪点提高,有利于改善电解液的低温和安全性能。电解液在氟代碳酸酯形成的电解液中的循环效率和安全性能同样有所提高。这类添加剂借助卤素原子的吸电子效应提高中心原子的的电子能力,使添加剂在较高的电位条件下在负极界面还原并有效钝化电极表面。
·FEC用途:
①锂离子二次电池电解液的成膜添加剂;
②改善低温性能。
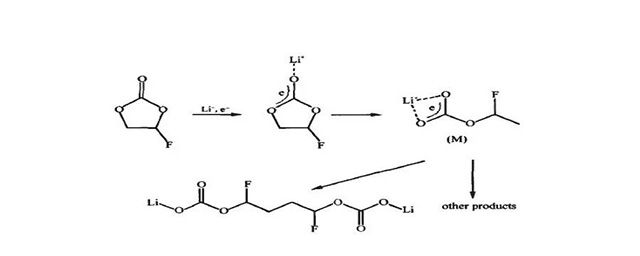
·如图所示,FEC中C=O上的O与Li+有强配位作用,得到外界一个电子后还原生成一自由基负离子中间体M,M有很高的反应活性,比如可以发生二聚反应或与其它反应中间体发生反应生成其它产物等。在较高还原电位下,生成的含氟产物旨先占据MCMB电极表面的活性位点,能有效抑制较低电位下电解液溶剂的分解。
·美国专利报道,电解液中添加FEC,可以抑制负极的损坏,提高电池的循环性能。
·从结构上看,FEC在Si负极处失去F,分解成与VC具有类似结构的物质,该物质会于4.3V (Vs.Li/Li+)电压或更高时在正极处发生分解(类似VC),产生气体。如果在电解液中加入LiBF4,则LiBF4首先与Si负极表面反应,生成含F的表面膜,从而抑制FEC与Si负极的反应,减小FEC的分解,进而抑制气体的产生。专利还指出,LiBF4的最佳加入量为0.5~ 1.0mol/L,其它锂盐如LiPF6等加入量为0.1~1mol/L,FEC的加入量为2~ 10wt%。
·美国专利报道,电池在首次充电过程中,相对于普通的溶剂体系,FEC在较高的电位发生还原分解反应,从而在碳负极表面形成稳定的钝化膜而抑制电解液的分解,减少容量损失,充分提高电池的容量效率及寿命。
·同时,该专利指出,FEC比CI-EC形成的SEI膜更稳定。这是因为,FEC在反应形成SEI时,不会生成电解液可溶的卤代物,而CI-EC电解液体系中,在形成稳定性稍差的SEI膜的同时,还生成可溶的LiCI。该氯化物能类似于氧化还原飞梭电对,从负极迁移到正极被氧化生成Cl2,而Cl|2又能从正极迁移到负极被还原成C上,从而造成低的容量效率。
·在低温充电时,负极表面容易发生Li沉积,生成锂枝品,从而影响电池的各项性能。锂枝晶的形成与SEI膜的表面形貌相关,不均匀的SEI膜导致不均匀的电流分布,是生成锂枝品的主要原因。
·该文献还指出,FEC可以失去一个HF分子而生成VC,而HF可以与SEI膜的碱性组分反应生成均匀的、富含LiF的SEI膜,从而有效的抑制锂枝晶的生成,改善循环性能。
分子结构
物理性质
闪点: -15°C
熔点: -41.9°C
沸点: 82.8°C
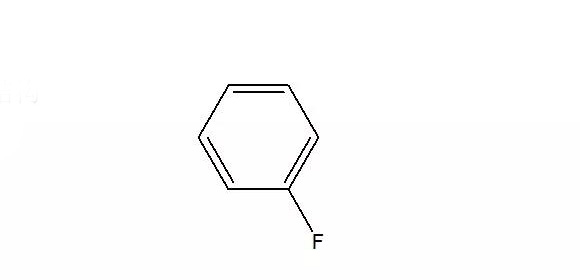
·目前国内尚未有文献报道关于FB用于锂离子电池电解液,通过文献搜索,在三星专利中有针对FB使用的专利,详细信息概括如下:
·相对于通常的含碳酸酯电解液相比,加入较大含量的FB可以改善电池的性能,从电池的低温性能、电池寿命和高温放电能力来看,均有明显的优点。
·三星SDI专利中1对使用FB,做了如下介绍:改善电池的充放电循环效率,以及电池在高温储存条件下的性能,对低温放电性能也有所改善。加入较大含量的FB可以改善电池的性能,可减少电池高温储存(60°C,30天)后的放电容量损失(原文中表2):
[1] Jong Seob Kim. US 6855458 B1,2005.
·专利1中具体的实施案例为:
1.EC/DMC/FB=1:1:1,将此配方使用在18650电池中,初始效率比不含FB的配方高出1%,-20度的额定放电容量高出60%以上;
2. EC/DMC/DEC/FB=3:3:1:1,高温放电能力比不含FB的配方高出4%, 初始效率和低温放电能力也有所改善;
·三星SDI专利[2]提到,若FB的含量小于8%(V:V),改进低温特性的效果将可忽略不计,但是若FB含量高于15(V:V),则当电池在高温条件下储存时会引起电池厚度的增加,从而使电池的安全性受到损害。
[1] Jong Seob Kim. US 6855458 B1,2005.
[2] Kwang-chun Kim. us 0095507 A1 ,2005.
含硫有机成膜添加剂
·含硫有 机成膜添加剂包括亚硫酸酯、亚砜类和磺酸酯添加剂。
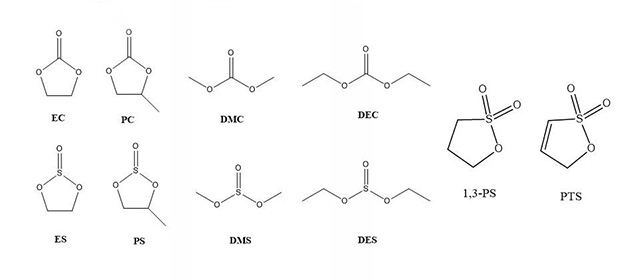
碳酸酯、亚硫酸酯、磺酸酯的结构式
·亚硫酸酯添加剂的结构与EC、PC、DMC和DEC相似,但由于中心硫原子的电负性更强,它们在石墨表面的还原性比相应的碳酸酯强,还原电位在1.7~2.1V之间;因此,亚硫酸酯添加剂能先于溶剂在石墨表面还原形成稳定的SEI膜,而且对正极材料的电化学性能影响不大。
·Ota研究表明,亚硫酸酯添加剂在石墨表面还原分解形成SEI膜的主要成分是无机盐Li2S、Li2SO3、Li2SO4和有机盐ROSO2Li,具体成分与电流密度有关,在高电流密度下,首先生成无机锂盐,0.5V以下才出现有机锂盐成分;在低电流密度下,1.5V 就出现有机锂盐,之后不再有无机盐的生成。
-PS
·PS是含硫的有机溶剂,是重要的有机成膜添加剂之一,结构与PC结构相似。
·但是由于中心S原子的电负性更强,在石墨负极界面的还原性比相应的碳酸酯强,亚硫酸酯的还原电位在1.7一2.1V左右,明显高于溶剂化锂离子的嵌层电位,加入PC基电解液中可先于溶剂化锂离子嵌层在电极界面形成稳定的SEI膜,避免PC分子嵌层对电极的破坏,使石墨电极在其中可以进行有效的嵌、脱锂循环。
·PS分子中的-SO3-基团的O原子与Li+间强烈的配位作用导致PS分子五元环断开,Li+得到一-个电子后形成阴离子自由基。由于阴离子自由基非常活泼,反应活性特别高。在进一步生成LiSO3,从而在石墨电极表面包覆一层致密、稳定的SEI膜,有效的提高了电极电化学性能和电池的储存性能及自放电性能。
使用含和不含Ps的两种电解液的电池在70°C和180°C下搁置24小时后在室温下的做放电实验:
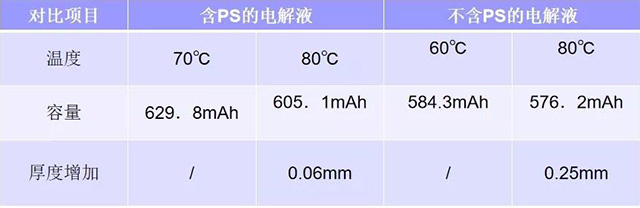
说明添加剂PS的加入提高了电池高温下放电的容量和安全性能。
·以PS为代表的亚硫酸酯类作为锂离子电池电极也也存在明显不足:
1.这类化合物与低黏度的醚类(如DME)共存时稳定性差,难以与醚类化合物配合使用;
2.这类化 合物在EC基电解液中对石墨负极的电化学性能的改善不利;
3.这类化合物在石墨负极界面形成的SEI膜稳定性差,随着循环次数的增加,电极界面电阻逐渐升高,电池的电子极化现象愈来愈严重, 从而导致电极的可逆容量迅速降低。
基于以上不足,亚硫酸酯类添加剂在锂离子电池有机电解液中的应用受到限制。
·通过PS和VC在天然石墨电极表面的交流阻抗行为发现:在初次循环过程中,VC的成膜反应电阻和锂离子发生电子交换反应的电荷传递电阻都明显小于含有PS的体系,这样当电流经过时候,锂离子在电解液和界面膜的迁移更加容易,由电极极化和欧姆内阻所造成的阻力就会减小,从而提高了电池的容量和平台;
·另一方面,也说明在还原反应过程中,VC的反应更加容易得到电子,形成SEI膜的效率高,因此能有效抑制溶剂的还原反应;而在含PS的体系中,由于电子转移电阻相对较大,PS的反应速率低,不能在第一时间形成完整的SEI膜,因此不能阻止随后的溶剂参与成膜反应,如用在含PC的溶剂体系中会导致PC的还原,进而影响电池的容量。
磺酸酯类添加剂- 1,3-PS
·磺酸酯是一种重要的有机成膜添加剂,烷基磺酸酯如1,3-丙烷磺酸内酯(1,3-PS)、1,4-丁烷磺酸内酯(1,3-BS)及1,3-丙烯磺酸内酯(PTS)具有良好的成膜性能和高低温导电性能,是近年来人们看好的锂离子电池有机电解液添加剂,尤其是用在负极为石墨、正极为尖晶石LiMn2O4的锂离子电池电解液中,电池的高温性能明显改善。
·刘建生等1在1 mol/L的LiPF/EC+EMC+PC (体积比3:6:1)电解液中加入3%wt的1,3-丙烷磺酸内酯(1,3-PS),发现在60 °C下满充电放置7天,电池的容量保持率和容量恢复率均比电解液中未加入1,3-PS电池的容量保持率和容量恢复率提高15%左右。
[1]李永坤,张若昕,刘建生.电池工业,第13卷.第5期,2008.
磺酸酯类添加剂-1,3-PS
·Zuo等[21研究发现,在1M LiPF;PC/EC/EMC为1:1:3的电解液中,加入1%w.t.1,3-PS,能将电池的首次放电容量提高8%;放电电压也有所提高,放电到200mAh的电压由3.7V提高到3.8V;加入1,3-PS后,电池循环100周容量保持率由95 2%提高到97.1%。
·CV测试表明,1,3-PS在0.7V电位下在石墨负极表面还原生成致密的SEI膜,抑制溶剂的还原分解(EC在石墨电极的还原电位为0.5V左右);这种优质膜的形成,能大大提高石墨/钴酸锂电池在高温80°C储存后和低温-20°C的放电容量。-20°C下的放电容量提高了23.5%;放电到300mAh的电压由3.25V提高到3.45V;1,3-PS的加入可使80°C储存4h后的放电容量提高8.9%。
[2] Xiaoxi Zuo, Mengqing Xu, Electrochemical and Solid-State Letters, 9 (4) A196-A199 ,2006.
磺酸酯类添加剂-1,4-BS
·Xu 等3I在1 mol/L的LiPF6/EC+ PC+ EMC (体积比1:1:3)电解液中加入1%wt的1,4-丁烷磺酸内酯(1,4-BS),电池的首次不可逆容量大大降低,循环性能有很大改善。研究发现,1,4-BS 在负极石墨表面还原形,成优质的SEI膜,抑制溶剂的进一步还原和PC嵌入石墨层间。
[3] XuM Q, LiW s, Zuo X X, et al. Journal of Power Sources,2007, 174: 705-710.
磺酸酯类添加剂-PTS
·桧原昭男等[4]在专利中介绍了在1M LiPF6,EC/EMC为4:5的电解液中加入1.5%wt的1,3-丙烯磺酸内酯(PTS),与LiCoO2和天然石墨材料组装成电池。
·PTS的氧化电位为4.4V (v.s.Li/Li+),还原电位为1.64V;
·测试电池在高温保存中的气体发生量(0.21m)远小于电解液中加入1,3-丙烷磺酸内酯的电池的产气量(0.34ml);而1,3-丙烯磺酸内酯与碳酸亚乙烯酯混合使用,可以降低电池的自放电率,并可抑制负荷特性和阻抗变化的劣化。
[4]桧原昭男,石田达丽,平野千穗电解液用添加剂,使用该添加剂的非水电解液及二次电池:中国,02127603.X[P].2006-04-5.
硼酸酯类添加剂
·硼酸酯溶剂沸点高(>300°C) ,熔点低(<100°C) ,抗氧化性强;如硼酸二己醇酯(BEG)与PC或EC混合的硼溶解lmol/L LiCIO4,制的的电解液的氧化电位大于5.8V(vs.Li/Li+),与碳负极相容性好,电极材料在其中具有优良的循环性能。
·三甲氧基硼烷或三甲基硼烷加入电解液中也可改善电池的循环性能。在ImolL LiPF6/EC+EMC电解液中溶入1%的三甲氧基硼烷,可以使C/LiCoO2电池的寿命延长50%。
·含硼化合物的加入有负面作用,会增加了电池的首次不可逆容量损失,添加量较大时会导致体系的热稳定性下降,也影响了电解液的离子导电性:其添加量一般不超过2%。
有机饰膜添加剂
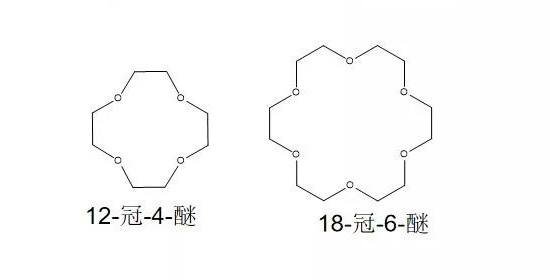
·溶剂中加入冠醚(如12-冠-4-醚) 不仅能增大电导率,还能减小电极首次充放电容量损失。
·冠醚对碳负极界面SEI膜的优化不是通过添加剂自身的还原分解在电极表面优先成膜,而是12-冠-4-醚分子能与锂离子发生配位作用,优先与锂离子溶剂化,削弱锂离子与溶剂分子间的相互作用;形成的锂离子溶剂化半径小,迁移速度快,在充电过程中优先到达负极表面。从而抑制溶剂在负极界面发生还原反应的强度,保护了碳负极的结构,降低首次充放电的不可逆容量。
·红外光谱分析表明,SEI膜的主要成分是EC分子的还原产物,没有12-冠-4-醚的还原产物;12-冠-4-醚并不直接参与SEI膜的形成。
有机饰膜添加剂
·12-冠-4-醚改善电解液性能的原因是它与锂离子配位的体积大小合适,也满足锂离子的配位数为4的要求,可优先与锂离子发生溶剂化作用,消弱PC分子与锂离子的相互作用: 18-冠-6-醚分 子优化SEI膜的作用不明显。
·研究发现PC基电解液中添加适量四乙醇二甲醚(tetraglyme) 有助于形成稳定的钝化膜;
·醚类毒性很强,这限制了它在工业中的应用。
锂离子电池过充保护添加剂
结构式:
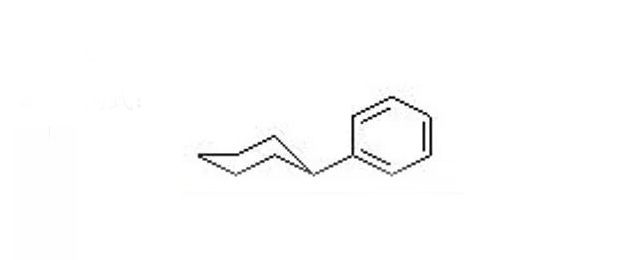
·在锂离子电池电解液中添加防过充类添加剂可以提高锂离子电池的安全性能,且含苯环类添加剂具有较好的过充性能。
·少量的环已基苯添加剂能够对电池起到保护作用的原因,是因为环已基苯在较低电位下聚合放出的热量使电池隔膜闭合增大了电池内阻,导致电池电压迅速上升,避开了电解液氧化;
·目前对苯环化合物作为防过充机理存在两种解释:
1.自放电机理
当电池充电到一-定 电压时,添加剂单体发生聚合,在正极表面生成导电聚合物膜使电池自放电至安全状态;
2.阻断机理
电池电压超过添加剂的电聚合电压时,添加剂单体发生聚合反应,生成聚环己苯,在电极表面形成阻断层,使电池内阻迅速增大,从而减缓或阻止电解液的进一步 分解,防止热失控,保持电池处于安全状态;
·锂离子电池电解液的过充保护添加剂一 般需满足以下条件:
(1)过充添加剂的氧化电势应高于满充电锂离子电池电压(4.2V(Vs.CgLi),4.3V Vs(Li/Li+)),小于完全脱嵌的钻酸锂电极的电压(4.3~4.7V (Vs.CgLi) ,4.4~4.8V Vs (Li/Li+) ),即氧化电位应该在阴极充电截止电势和电解液氧化分解电势之间;
(2)过充添加剂的氧化反应速度越快,则对电解液的过充保护效果越好;同时,过充添加剂不能严重影响锂离子电池的充放电循环性能。
·环己基苯的氧化电压约为4.6-4.7V,因此与不含环已基苯添加剂的电池相比,环已基苯聚合反应先于电解液氧化反应发生并放出热量,同时生成氢气,造成电池表面电压升高或体积膨胀。
·通过实验,环己基苯(CHB)的放过充机理为:去氢电聚合阻断机理,即发生过充时,CHB单体发生去氢电聚合形成聚环已苯,并产生氢气,是电池内阻增大而阻止电池的热失控发生,提高电池的过充安全性能,因此CHB也称为电聚合保护添加剂。
1.CHB添加剂对电池电导率的影响
电导率是影响锂离子电池性能的一个重要参数,如果锂离子电池电解液的电导率不够,降低导电锂盐的解离,进而影响锂盐对碳负极共插而引起对负极的破坏。
实验实例:随着CHB浓度增加电解液电导率几乎呈线性下降,表明添加环已基苯对电解液的电导率负面影响,同时每增加1%,电解液的电导率下降大约2.5%;当电解液中CHB的含量比例达到9%(质量比)电解液的电导率与纯电解液相比下降了25%,这也可能是高比例CHB电解液导致电池循环下降的原因之一。
2.CHB对电池循环性能的影响
(1) CHB对正极(LiCoO2) 的影响
电解液中添加ICHB后使LiCoO2的容量有一定程度的增大,但循环稳定性变差了,容量的衰减变得更快一些,而且在随着添加含量的增大(<2%)时,容量是变大的,添加2%CHB的容量最大,但CHB含量继续增大后(>2%)时,反而使容量下降,而且容量衰减越来越快。
总体来说,添加CHB使正极材料容量增大,稳定性稍有衰减。
(2)CHB对石墨负极的影响
添加少量的CHB(<3%)使负极石墨的容量有些许提高,循环稳定性和空白试验的基本一致,首次充放电效率都能达到82%左右,循环50次后容量仍能保持在320mAh/g左右。但添加CHB量变多(>3%)之后,负极循环性能变差,首次充放电效率只有70%左右,不可逆容量增大,放电容量也下降,循环稳定性也变差,容量下降的很快。
说明添加CHB量的多少对石墨负极的影响较大。
·由此说明较高比例的CHB对电池的循环性能有负面的影响;此外,CHB的加入使电池的阻抗略有浮动,但影响不大。
3. CHB添加剂对电池自放电的影响
添加不同比例的CHB的电池,自放电都有一定程度的增加。同空白电池相比,电池的自放电程度随着CHB的增加而逐渐增加,含9%CHB的电池的自放电最为严重,但储存15d后容量保持率依然高达98.7%;
说明尽管CHB添加剂对电池自放电有负面影响,但是这个影响是非常小的。
结构式:
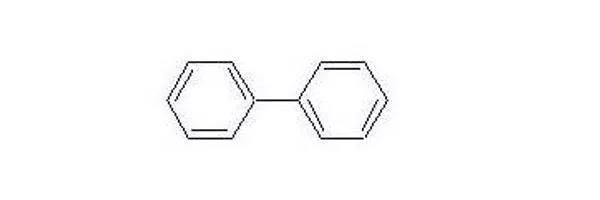
·联苯的聚合电势为4.7v(W.Li/Li"),可在过充时发生电聚合反应,在电池正极表面形成一层导电聚合物膜,增加电池的内阻,阻断充电,提供过充保护,有利于减低降低充电电流。
·过充机理: BP跟CHB-样, 都是电聚合类添加剂
在过充状态下,由于BP的电聚合反应,使电池内压和温度提前增大,提高了与其联用的保护装置的灵敏度,使电池处于非危状态,有效地改善了电池的过充安全性,在深度过充状态下,空白电池极易发生爆炸燃烧;而加了BP的电池因压力阀提前开启,使电池始终处于安全状态,从而提高电池的安全系数。
BP + (BP)n→(BP)n+1+2H++2e-
2H+ + 2e--→H2
·在电解液中加入10%的BP后,电池的放电容量仅降低了2.2%,电池在充放电100周循环之后,电量损失约10%,提高BP的浓度,发现电解液聚合反应速度加快,电池的最高温度降低,但电池的循环性能降低、胀气程度增大。
·为了改善电池的循环性能,加入BP的同时,又加入叔戊基苯,电池循环性能略有提高,300周次循环后电池容量热能保持在82%以上,BP与叔戊基苯共同使用对锰酸锂、镍酸锂、钴酸锂为正极的18650电池都有明显的过充保护作用;
·为了抑制电池胀气,Roh等人在电解液中加入6%BP的同时,添加2%的含氮化合物和少量的蔡-1,8-磺酸内酯,控制电池的体积膨胀。
·含CHB电解液的Li循环效率比含BP电解液的循环效率高很多,与标准电解液的Li循环效率接近,说明在改善循环效率方面,CHB过充添加剂比BP过充添加剂好。由于BP的一个芳香环被氢化后,其还原性降低增强了CHB在锂电极的电化学稳定性,这种芳香环的氢化减少了化合物电子数。导致氧化性降低,化合物的电化学聚合反应速率降低,因此单纯就
氧化反应速率而言,BP比CHB对电解液的过充保护效果更好。
·eg: CHB的氧化电势为4.72V,BP的氧化电势为4.54V;CHB的最大氧化电流为-6.23×10-4A,BP的最大氧化电流为-1.02 x10-3A;
氧化还原飞梭型抗过充添加剂
·具有橄榄石结构的磷酸铁锂是-种应用前景十分广阔的锂离子二次电池正极材料。LiFePO,的理论比容量为170mAh/g,相对于锂金属,负极的稳定放电平台为3.4~3.5 V。
·日前应用中多采用电聚合类添加剂(CHB/BP等),来提高电池的安全性:然而当聚合反应发生时,电池的寿命即终止:动力电池成本较高,采用此方法代价过大,不符合降低成本的要求。
氧化还原飞梭
·增强电池抗过充性能的另一种方法是,加入氧化还原对添加剂:当电池正常充电时,该氧化还原对不参加任何化学或电化学反应:当充电电压超达到添加剂的氧化电位,添加剂开始在正极发生氧化反应,氧化产物扩散到负极,发生还原反应:吸收多余的电荷,形成内部防过充电机制,显著改善电池的安全性能。
对此类添加剂的要求:
(1)其氧化电位应稍高于电池充电截止电压(3.6V),低于溶剂氧化电压; (2)氧化还原过程中副反应要少,可逆性好,避免添加剂的消耗;
(3) 溶解度大,扩算速度快;
(4)与正负极相容性好,对电池性能无负面影响。
氧化还原飞梭
·Claudia等 [1]研究了多种烷基、甲氧基芳香族化合物的氧化电位和抗过充性能。
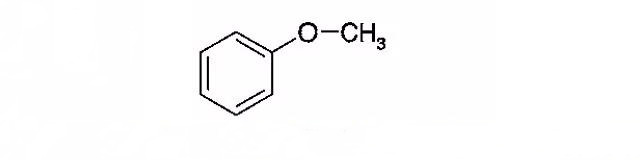
·氧化电位采用CV描测试,过充测试在4.9V、0.1C、10h过充100%条件下进行:电池为LiFePO4-MCMB体系,电解液为0.7 M LiBOB,EC/PC/ DMC/DEC(体积比1:1:2:2)。
·苯甲醚氧化电位为4.2V,电解液中加入0.1M苯甲醚,可承受上述过充测试33次;2-溴苯甲醚的氧化电位为4.35V,其浓度为0.1M时可抵抗12次过充。
结构式如下:
[1] Claudia Buhrmester, Jourmnal of The Electrochermical Society, 152 12 A2390-A2399 2005.
氧化还原飞梭
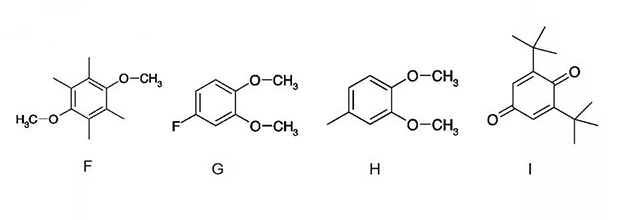
·4-甲基-邻二甲氧基苯(F)、4-氟取代邻二甲氧基苯(G)和2,3,5,6-四甲基-对二甲氧基苯(H)的氧化电位都为4.1V,浓度为0.1M时分别可承受15次、18次、 16次过充测试;
·2,6-二叔丁基-1,4-苯醌(I) 在4.1V发生氧化反应,浓度为0.1M时可承受9次过充;
结构式如下:
DDB
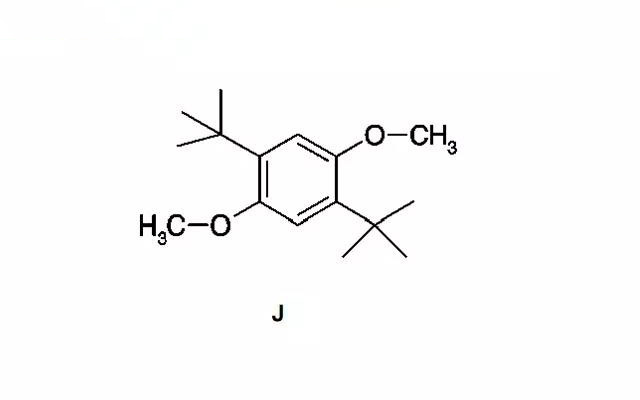
·2,5-二-叔丁基-对二甲氧基苯(DDB) (J)氧化电位为3.92V,CV测试显示其氧化还原反应可逆性好,副反应少;浓度为0.08M时,电池可承受300次过充测试。
DDB
2,5-二-叔丁基-对二甲氧基苯
·苯环上含有aH,卤素原子的化合物,其氧化还原可逆性较差;
·苯环上有叔丁基之类的较大基团,可以保护S+稳定存在,减少副反应,提高氧化还原的可逆性。
TDB
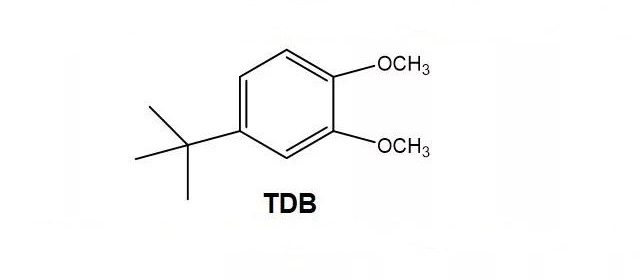
·H.X. Yang[2]报道了另一种芳香族物质- 4-叔丁基-邻二甲氧基苯(TDB) ;
·以Pt盘电极为工作电极,Li片为参比电极,对浓度0.1 M TDB的1M LiPF6/ EC + DMC (1:1 v/v)的电解液进行CV测试,结果显示,TDB在4.1V发生氧化,其氧化峰在4.25V,与LiFePO,电池的充电截止电压(3.6V) 间距0.5V;随后进行1000周CV扫描,所得曲线重复性好,说明TDB的氧化还原反应可逆性好,副反应少。
[2] J.K. Feng, X.P. Ai, YL. Cao, H.X. Yang, Electrochemistry Communications 2007 ,9.25-30.
TDB
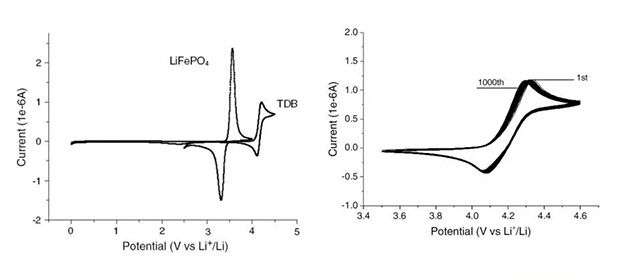
TDB
·对0.1 M TDB 1 M LiPF6/ EC + DMC (1:1 v/v)的电解液组装成的LiFePO,-Li半电池,可承受5V、 0.5C过充测试。
·实验结果显示,当TDB浓度小于0.2M时,对溶液电导率的影响极小,超过0.2M时,电导率会逐渐降低。
阻燃添加剂
·P/F/CI/Br都是优良的阻燃元素,但是由于含卤阻燃剂存在的环保问题,一直被国内外相关行业限用,所以阻燃添加剂大多为含磷有机物,含氟有机物和含磷氟的复合有机物。
·电解液之所以会发生燃烧,是因为其本身发生了链式反应,如果能找到抑制这些链式反应的添加剂,将能有效提高锂电池的安全性。
·大部分所认可的阻燃添加剂作用机制是自由基捕获机制,基本原理是,阻燃添加剂受热时,释放出具有阻燃性能的自由基,该自由基可以捕获气相中的氢自由基或氢氧自由基,从而阻止了这些自由基的链式反应,使得有机电解液的燃烧无法进行或难以进行,提高锂电池的安全性能。
有机磷系阻燃剂
·近年研究最多的一类阻燃剂,如烷基磷酸酯类,苯基磷酸酯类和环状磷睛类等,这些化合物常温下大部分呈液态,与非水介质有一-定的互溶性,是锂电池电解液重要的阻燃添加剂。
·报道的有磷酸三甲酯(TMP),磷酸三乙酯(TEP),磷酸三苯酯(TPP)和磷酸三丁酯(TBP),磷腈类有六甲基磷腈(HMPN);将上述磷系阻燃添加剂进行系统的对比研究,结果表明,许多有机磷系阻燃添加剂粘度较大,加入后会降低电解液的电导率,而且电化学稳定性差,其中HMPN有较好的稳定性,对电解液性能影响不大,是比较理想的阻燃添加剂。
·TMP作用机制是自由基捕获机制,在受热的条件下首先气化,气态TMP分子分解释放出含磷自由基,含磷自由基与氢自由基结合,此反应能降低体系中氢自由基的含量,有效阻止有机溶剂的燃烧或爆炸。虽然TMP同锂离子一起有向石墨共嵌的趋势,但是可以通过降低TMP的浓度或使用不规则的碳负极活性物质来减少这种趋势。
有机氟系阻燃剂
·近年来研究者逐渐将研发重点转向含氟酯类和醚类有机氟系化合物。氟取代有机溶剂中的氢原子后,溶剂分子的含氢量降低,可燃性降低,闪点升高,添加至电解液中能明显改善电解液的热稳定性;同时,借助F元素的吸电子效应,还有利于提高溶剂分子在碳负极表面的还原电位,优化固体电解质界面膜,改善电解液与活性材料的相容性,进而稳定电极的电化学性能;
·氟代环状碳酸酯类化合物,如一氟代甲基碳酸乙烯酯(CH2F-EC),二二氟代甲基碳酸Z烯酯(CHF2-EC)和三氟代甲基碳酸乙烯酯(CF3-EC)等,都具有较高的闪电和介电常数,都能够很好的溶解锂盐电解质,并与其它有机溶剂互溶,添加此类氟代碳酸酯类化合物表现出了良好的充放电能力,循环性能和阻燃性。
有机氟系阻燃剂
·同时也有学者研究了氟代链状碳酸酯类化合物在锂电池中的应用,如二氟乙酸甲酯(MFA)和二氟乙酸乙酯(EFA),这些氟代酯类不仅具有良好的高温性能,而且粘度小,熔点低,低温性能良好;
·研究氟代醚类化合物阻燃剂,将甲基氟代丁基醚(MFE)添加到LIBETI电解液体系中,发现电解液无闪点,在针刺和过充实验中均未出现着火现象,电池安全性能大大提高;
·全氟代丁基磺酸钾(PNB)作为电池的阻燃添加剂,当添加PNB在电解液中的含量在0.8%时,电解液的火焰传播速率'下降24%,阻燃作用表现非常显著,150次循环后电池容量没有明显的下降;
·有机氟系化合物虽然综合性能好,但是制造成本普遍偏高,所以真正应用到商业电解液阻燃添加剂的很少,现处于实验室研究阶段;
复合阻燃添加剂
·目前用于锂电池中的复合磷酸酯类化合物主要是磷氟类化合物,特别是氟代磷酸酯类化合物。
·此类化合物具有P和F两种阻燃元素,具有协同作用,可降低添加剂用量,可提高阻燃效率;同时F元素的存在有助于电极界面形成优良的SElI膜,改善电解液与活性材料间的相容性,F元素还可以削弱分子间的粘性力,使得分子,离子的迁移阻力减小,进而降低其粘度,改善电解液电导率。
·一系列的氟代烷基磷酸酯类化合物,包括三(2,2,2-三氟乙基)磷酸酯(TFP),二(2,2,2-3三氟乙基)甲基磷酸酯(BMP)和(2,2,2-三氟乙基)二乙基磷酸酯(TDP),测试发现三者均能在保持电解液电化学性能的前提下,具有阻燃性能,并且阻燃效果明显优于烷基磷酸酯添加剂。
电解液稳定添加剂
稳定添加剂
·锂离子电池电解质的不稳定性表现在以下两方面:
(1) LiPF。热稳定性,极易分解,LiPF。#PFs +LiF;
(2)产物PFs是一种很强的路易斯酸,与有机溶剂发生反应的活性高;而且PFs会使石墨负极表面的SEI膜稳定性恶化,因为PFs 会与Li2CO3 , RCO2Li, ROCO2Li,H2O, 甚至与杂质反应[1].
Li2CO3+ PF5→POF3 +2LiF + CO2
RCO2Li + PFs→RCOF + LiF + POF3
ROCO2Li + PFs→RF + LiF + CO2 + POF3
·上述反应产生了气体,导致电池内压升高:负极SEI膜中的LiF含量会升高。
[1] S. S. Zhang, Journal of Power Sources ,162 (2006)1379- -1394
稳定添加剂
提高LiPF。电解液的稳定性有两个思路:
1.抑制LiPF。的分解
Hiroi[2]在专利中指出,在LiPF6为溶质的电解液中加入0.05wt%的LiF可以有效减少产气量;根据化学反应平衡原理,LiF 的加入使LiPF6的分解反应受到抑制。
2.另一个方法是在电解液中加入少量的路易斯碱化合物,来减弱PF5的反应活性;由于PFs得电子能力强,很容易与含孤对电子的物质起作用。
[2] O. Hiroi, K. Hamano, U.S. Patent 6305540,2001.
稳定添加剂
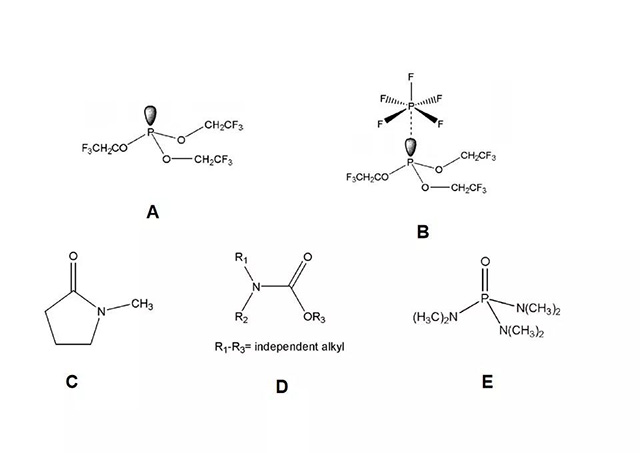
·加入的添加剂必须是弱碱性的,否则会促进LiPF:的分解平衡正向移动;如3-(2,2,2-3氟)乙氧基磷(TTFP)[3](A)能与PF;发生较弱作用形成化合物(B) ;
·与-C=O,-P=O等拉电子基团相连的N原子上的未成对电子,能够与PF5发生作用,减弱PF5的活性,从而达到稳定电解液的目的。
·根据上述原则,许多氨基化合物也能作为LiPF6稳定剂,例如N-甲基-2-、吡咯烷酮[4](C)(NMP),氟化氨基甲酸酯[5](D),六甲基磷酰胺[6](E)(HMPA)。
[3] S.S. Zhang, K. Xu, T.R. Jow, J. Power Sources 113 (2003) 166
[4] X. Wang, H. Naito, J. Electrochem.Soc. 152 (2005) A1996.
[5] K. Appel, S. Pasenok, U.S. Patent 6,159,640 (2000).
[6] W. Li, C. Campion, J. Electrochem. Soc. 152 (2005) A1361.
稳定添加剂
稳定添加剂-吡啶
·WLi[1]在文献中报道,在1M LiPF6 EC/DMC/DEC为1:1:1的体系电解液,不添加吡啶的电解液在85°C储存2天,溶液变褐色;加入3wt%的吡啶的电解液在85°C下储存2天,不变色;继续加热24天,电解液保持无色,经检测未发现电解液分解产物。不过吡啶的加入会导致电池的容量稍有降低。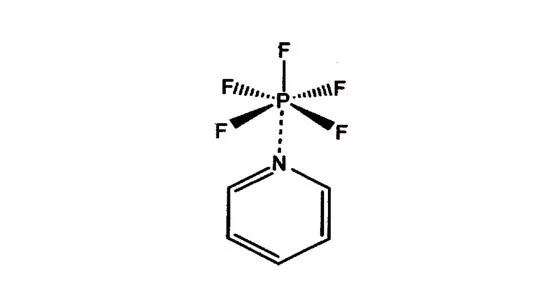
[1] Wentao Li, Christopher Campion. Joumal of The Electrochemical Society, 152 (7), A1361.A1365 ,2005.
稳定添加剂- HMPA
·另一种稳定添加剂是HMPA;含3wt% HMPA的1M LiPF6 EC/DMC/DEC (1:1:1) 电解液,在85°C 下储存8800h (366天),电解液不变色,成分分析只检测到痕量的分解产物。
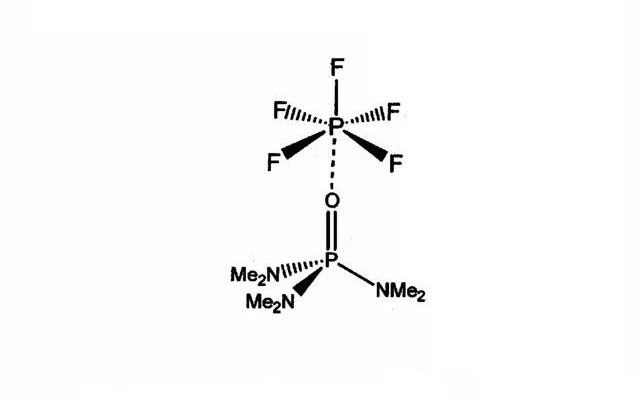
稳定添加剂- HMPA
·HMOPA也具有稳定电解液的作用;
·含3wt% HMOPA的1M LiPF6 EC/DMC/DEC(1:1:1)电解液,在85°C下储存2000h83天),电解液不分解不变色;继续加热2000h, 发现电解液开始分解。
·经分析,稳定剂失效的原因是,HMOPA在85°C下会逐渐发生结构重排,重排后的产物为氨类物质,不含具有弱碱性的亚胺基中的氮原子,与PF5作用较弱,其稳定电解液的能力较差。奇怪的是,当HMOPA浓度更高时,其稳定电解液的能力变差:含10wt% HMOPA的电解液,在85°C下储存800h (33天),即发生变色。
稳定添加剂-HMPA
·将含有3wt%HMOPA的电解液组装成扣式电池,测试发现HMOPA的加入使电池的容量稍有降低(2%)。进-一步的研究发现,HMOPA对减少锂离子电池满电高温储存的容量损失效果较差;含3wt%HMOPA的电解液和正极材料在85°C下储存30天,溶液中会出现凝胶;原因是HMOPA与正极作用发生开环反应,这个副反应使HMOPA在难以在实际中得到应用。
稳定添加剂- HMPA
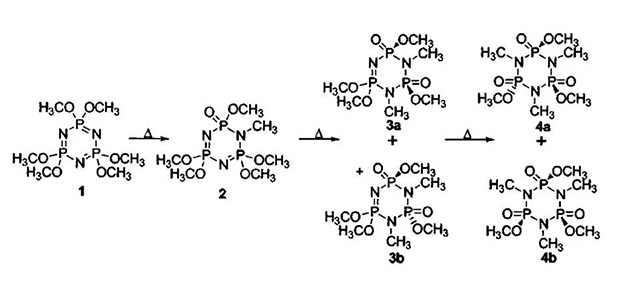
W. Li, C. Campion. J. Electrochem. Soc. 152 (2005) A1361.
除酸除水添加剂
·电解液中HF的存在, 会与SEI膜的成分反应,生成LiF,造成SEI膜的阻抗增大:
·同时HF会与正极材料(如LiMn2O4)反应,造成高价态金属(Mn)溶解,造成电池容量下降:
·胺类具有一定的碱性,可以与HF发生作用;
除酸除水添加剂-乙醇胺
·左晓希I1研究了乙醇胺作为功能添加剂的性能及对电池性能的影响。电解液采用1 mol/ L LiPF/ EC+ DMC+ EMC;在电解液中加入二次蒸馏水,使其中的水分提高到0.01%,再在部分电解液中添加0.1%的乙醇胺。将电解液在45°C下放置24 h,测试加入0.1%的乙醇胺前后,电解液中的H2O和HF含量。
·电解液中H2O与HF含量的测定结果/10-4%

[1]左晓希.电池,2005年,35卷,第5期,366-367.
乙醇胺
·未加乙醇胺的电解液在高温下,LiPF:与水反应完全,产生了大量的酸。在加了乙醇胺的电解液中,LiPF6与水的反应比较缓慢,只发生了部分反应,这说明乙醇胺抑制了LiPF9与水的反应,提高了电解液的稳定性。
·乙醇胺的加入不影响电解液与电池正、负极的相容性:在0-4.2V(vs.Li/Li+)的电压范围内,乙醇胺没有在负极发生还原反应,也未在正极上发生氧化反应,具有较好的电化学稳定性。
·乙醇胺具有较好的电化学稳定性,不影响电解液与电池正、负极的相容性。微量(0.1%)乙醇胺的加入,能抑制电解液中LiPF&的水解和热解反应,提高电解液的贮存稳定性和热稳定性;有利于SEI膜的稳定,减少了电池在前期循环中的容量衰减。
左晓希。电池,2005年,35卷,第5期,366-367.
乙醇胺
·电解液加入乙醇胺 后对电池稳定性和循环性能的影响; 4种电解液,匹配LiCoO2,复合石墨组成电池:

·循环80次后,使用电解液a、b、c和d的电池的容量衰减率是分别是6.7%、3.0%、17.1%和8.8%。使用电解液d的电池的循环性能比使用电解液c的电池的好;这是由于乙醇胺抑制了水与LiPF。的反应,提高了电解液的稳定性,改善了电池的循环性能。
[1]左晓希。电池,2005年, 35卷,第5期,366-367.
芳香胺
·美国专利21 US 5846673报道,具有芳基或杂环的有机胺类可用于降低电解液的酸度:三丁基胺可有效降低HF的含量,不过它在3.3V
(vs.Li/Li+)会发生氧化反应,不适用于4V级锂离子电池; 4-(N,N-2甲氨基)吡啶(DMAP),具有较强的抗氧化性,其氧化电位在4.4V左右;
·实施例: 将2w.t.%或5w.t.%的胺 类溶于起始电解液(1M LiPF6,EC/DMC 1:1,起始电解液中HF含量为100ppm),室温搅拌所得溶液3小时,然后测定每种电解液中的HF含量。
[2]在电化学电池中做添加剂的有机胺类,CN 1343024A.
芳香胺
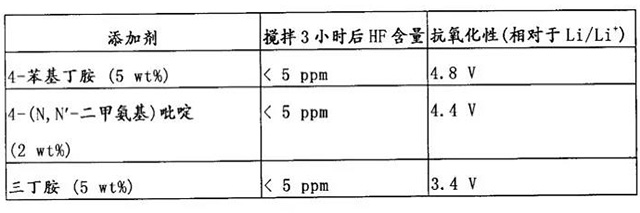
·从上表可以看到,上述三种胺类降低HF含量的效果均十分明显。以Pt电极为工作电极,Li电极为对电极和参比电极,对电解液进行循环伏安测试,分别得到他们的氧化电位;DMAP和4-苯基丁胺的氧化电位较高,可用于4V级锂离子电池;综合考虑,DMAP的降酸效果最佳。
硫氰酸酯
·国内专利1采用硫氰酸酯、异硫氰酸酯类添加剂作为电池电解液的稳定剂,这种添加剂具有良好的除酸、除水效果,能有效地消除电解液调制后长期储存时的变色现象;显著提高高温条件下电解液的稳定性,甚至在高达90°C的条件下长时间放置后,仍然能够保持无变色现象,游离酸、水分含量仍然维持在较低的水平,对电池电化学性能无明显影响。
·在1M LiPF6EC/DMC/DEC (1:1:1) 体系中,加入1wt%硫氰酸甲酯,储存60天后酸度小于12ppm,水分小于10ppm;
·硫氰酸甲酯的加入能提高LiCoO2石墨体系电池的容量保持率,加入量为0.5wt%时,循环10次后容量保持率比未加添加剂提高了4.5% (由94%提高到98.5%)。
·实验发现硫氰酸酯具 有较强刺激性。
[1]二次锂离子电池电解液的制备方法及其设备:申请号: 03113897.7, 2003年。
七甲基二硅氮烷
·添加剂七甲基二硅氮烷的加入,能控制电解液的酸度,使用该电解液制备电池能提高锂离子电池的循环寿命和高温储存性能。
·实施例一: 1M LiPF6 EC/EMC/PC质量比30/60/10, 2 w.t.% VC的电解液中初始水分为132ppm,酸度为9.8ppm;不加添加剂的样品放置一周后酸度为266.8ppm;加入0.1wt%七甲基二硅氮烷的样品,一周后的酸度为50.5ppm。
·实施例二: 0.8M LiBF4 EC/PA/DEC/PC质量比为30/10/50/10含2wt%VC,3wt% 1,3-PS并加入1wt%七甲基二二硅氮烷, 滴入一滴蒸馏水,测试样品中的水分为120.5ppm,HF含量为11.3ppm。放置-周后, HF含量为463ppm;而未加添加剂的样品酸度上升至243.1ppm。
一种锰酸锂电池的电解液,申请号: 200810218809.6, 2008年。
浸润性添加剂
·目前,液态锂离子电池电解液采用环状碳酸酯、链状碳酸酯混合溶剂;此类质子惰性溶剂粘度偏高,表面张力偏大;注液时,倾倒性不太好。另一方面,PE、PP隔膜材料与电解液的亲和作用小,导致电解液对隔膜的浸润性较差;由于电池容量的增加,电机组件密度增大,组件与壳体之间的空间很小,使得灌注电解液十分困难。
·质子惰性溶剂对高比表面的正、负极活性材料的润湿性不太好,这样会导致电极材料与电解液的接触电阻偏大,很难满足动力锂离子电池内阻小的要求;电解液对电极活性材料的浸润性差,会影响正负极材料的利用率,不利于电池容量的发挥。
浸润性添加剂
·通过加入非离子表面活性剂作为润湿性添加剂,可改善电解液的润湿性和倾倒能力。
·三星SDI专利1公开了一种包含润湿性活化剂的锂离子电池电解液;该电解液具有优异的寿命特性和高温稳定性并显示出改进的电解液倾倒性,采用的浸润性添加剂三烷基磷酸酯(L) 和碳酸二二烷基酯(M) ,结构式如下:
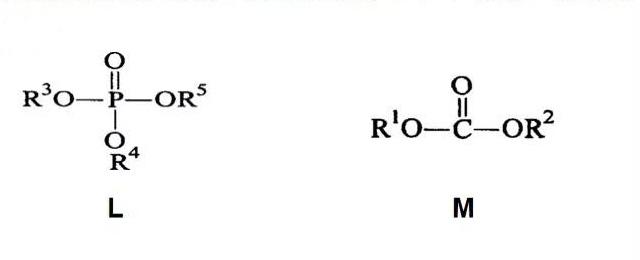
[1]锂离子二次电池:申请号: 200510107424.9,2005年.
浸润性添加剂
·电池材料体系为LiCoO2-人造石墨体系;组成为EC/EMC /GBL =3:7:3(体积比)的电解液,其注液时间随着碳酸二J基酯的含量增大而降低,循环寿命也有所提高;当添加剂含量低于0.1w.t.%时,不能改进电解液的倾倒性和循环寿命,当含量大于10w.t.%时,含量的增加对改善浸润性没有效果。加入7w.t.%的碳酸=二丁基酯,注液时间最短,由15min降低至4min。GBL的加入能有效提高电池在高温储存和过充电下的安全性能。
·而分别加入3w.t.%的磷酸三丁J 酯和磷酸三辛酯,注液时间分别降低为5.5min、4.5min。 在组成为EC/EMC=3:7(体积比)的电解液中,4w.t.%碳酸二丁基酯的加入不影响电池的循环寿命(90%-89%)。
锂离子二次电池:申请号: 200510107424.9,2005年.
浸润性添加剂-氟化醚
·松下专利1公开了一-种非水电解液,该非水电解液含有非水溶剂以及电解质盐,非水溶剂含有用下述式HCF2CF2CF2CH2-O-CF2CF2H表示的氟化醚。该非水电解液对聚烯烃制隔膜的润湿性良好,能够长期赋予电池以良好的负荷特性,在高温保存下的电池内部不易分解,很少产生伴随着分解的气体;并能在负极表面成膜,提高电池循环寿命。
结构式如下:
HCF2CF2CF2CH2-O-CF2CF2H (1)
CF.CFHCF_CH(CH) -0-CF.CFHCF (2a)
CF.CFHCF2CH(CH) -0-CF2CFHC.F (2b)
CF,CFHCF2CH (CH3) -0 -CF2CF.H (2c)
HCF.CH(CH) -0-CF2CFHCF3 (2d)。
[1]非水电解液以及非水电解液二次电池:申请号: 200910224520.X, 2009年11月
浸润性添加剂-氟化醚
·当含氟醚类(1)和(2a)总含量超过3w.t.%时,电解液显示出对聚烯烃隔膜表现出良好的浸润性;当氟化醚含量超过5w.t.%,电解液高温储存产气量显著降低。
·然而含氟醚类含量的增多,会导致LiPF。溶解量的减少,使电解液锂离子传导率下降;结构式为2a、2b、 2c、2d的物质,结构较复杂,对LiPF。的溶解量和锂离子的传导率影响较大;结构式(1)代表的物质对Li+传导率的影响较小,同时因该分子包含的氟原子较多,在负极成膜效果好。
·综上所述,成分为EC/PC/DMC的电解液中,使用3w.t.%的氟化醚(1)效果对浸润性的改善效果好,用量为5w.t.%时能显著改善高温储存产气量。
浸润性添加剂-硅烷化合物
·国内专利[1]报道了硅烷化合物浸润性添加剂(含碳氟键、碳硅键和硅氧键);该添加剂可用于解决了超级电容器电解液对电极材料润湿难的问题,降低了电解液的表面张力,提高了润湿性,降低了电解液与电极材料的接触电阻,提高了电极材料的利用率和比电容。
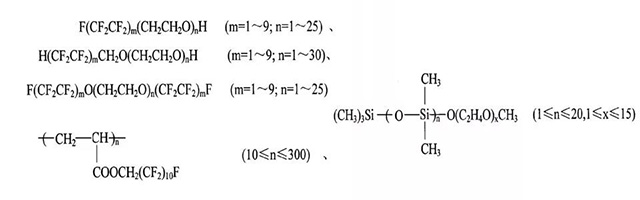
[1]一种超级电容器电解液:申请号: 200910036557.X, 2009年.
浸润性添加剂-硅烷化合物
·在1M Et,NBF4/PC电解液中,上述浸润性添加剂在电解液中的用量为0.05~0.3w.t.%,表面张力随表面活性剂添加量递减;加入0.25w.t.%的F(CF2CF2)m(CH2CH2O).H (m=1~9;n=1~25),电解液表面张力降为原来的38.9%。
·F(CF2CF2)m(CH2CH2O).H的效 果优于其他化合物。
三、电化学测试基本方法
电化学测试
·电化学测试简述:
·电化学测定方法是将化学物质的变化归结为电化学反应,也就是以体系中的电位、电流或者电量作为体系中发生化学反应的量度进行测定的方法。
·包括:
电流-电位曲线的测定;电极化学反应的电位分析,电极化学反应的电量分析;对被测对象进行微量测定的极谱分析;交流阻抗测试等。
·电化学测试方法的优点:
1.简单易行。可将一-般难以测定的化学参数直接变换成容易测定的电参数加以测定。
2.灵敏度高。因为电化学反应是按法拉第定律进行的,所以,即使是微量的物质变化也可以通过容易测定到的电流或电量来进行测定。
3.实时性好。利用高精度的特点,可以检测出微反应量,并对其进行定量。
三电极体系
·三电极体系;
·研究电极上电子的运动是电化学反应的基础,为了分别对电池或电解池的阴极,阳极发生的反应进行观察需用到三电极体系。
·电解池阴极表面发生还原反应,阳极表面发生氧化反应。
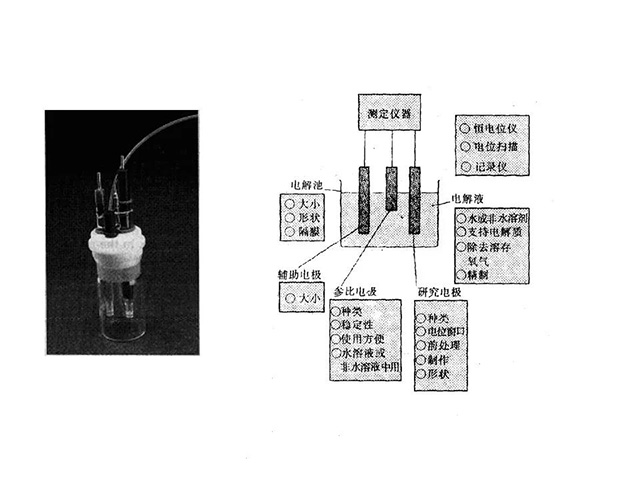
三电极电解池示意图
·参比电极,它的作用是为了测量进行这些反应的电极电位的一个基准电极。常用的参比电极有:饱和甘汞电极,氯化银电极,Li/Li+电极。
·被测定的电极叫做工作电极,与工作电极相对的电极叫做辅助电极。常用的工作电极:Pt电极,玻碳电极,石墨电极等。
·在三电极法中为了能够在测定工作电极和参比电极之间电压同时,又能任意调节工作电极的电位,理想的设备为电化学工作站。
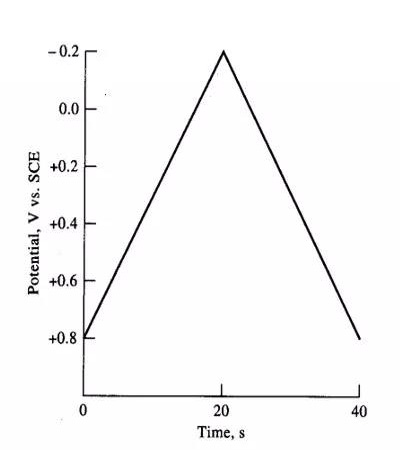
常用分析方法-循环伏安法
循环伏安法(CV)原理:
1.施加三角波电压
2.电压扫描速度10mV~ 1000mV/s
3固定电极溶液中有氧化态物质O时,在电极上被还原生成还原态R
O+ne-→R
回扫时R被氧化成O
R→O+ne-
循环伏安法的作用
·判断电极反应可逆程度
·扫描中发生的化学反应
·反应中间体
·相界吸附
·反应机理
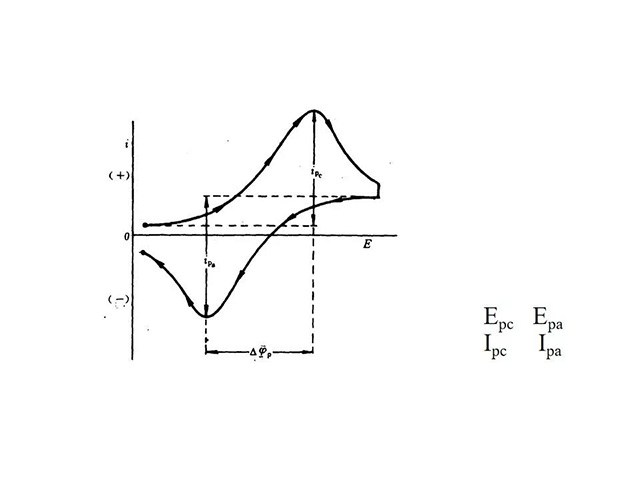
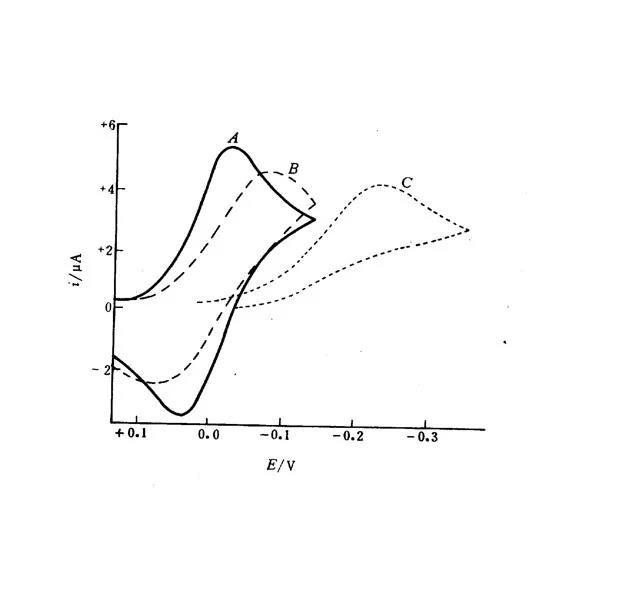
A=可逆电极过程;
B=椎可逆电极过程;
C=不可逆电极过程.
φpc=φ1/2-1.11RT/nF
φpa=ρ1/2+1.11RT/nF
△φ=2.22RT/nF =φpa——φpc= 56.5/n(mv)
55~65mv认为可逆,且ipa=ipcv 1/2
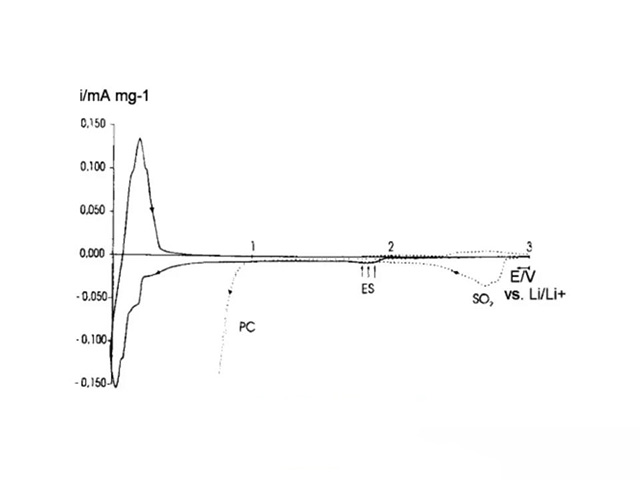
石墨电极的循环伏安曲线
电解液分别为添加5%ES和10%SO21.0M LiCIO4/PC
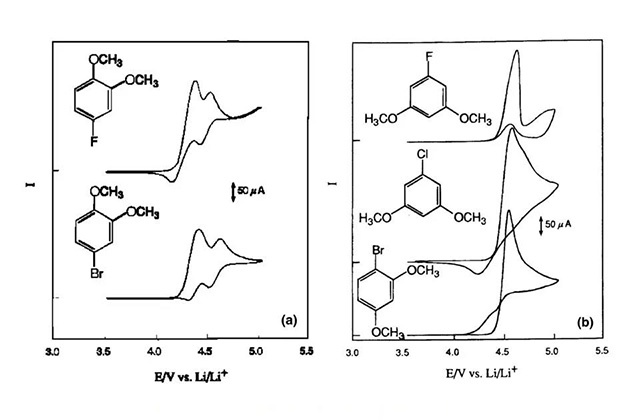
4-卤代-1,2-二甲氧基苯和1,3-二甲氧基氯代苯在LiPF6/PC/DMC溶液中的循环伏安曲线(Pt电极)
本文链接:https://www.nxebattery.com{dede:field.arcurl/}
诺信新闻,诺信公司新闻,锂电池行业新闻,展会新闻
上一篇:锂离子电池分选方法
下一篇:聚合物锂电芯和锂电芯哪个好?